Сегодня жизнь пациента с аллергией нельзя представить без применения антигистаминных препаратов (АГП). Как определить, какой из них будет наиболее эффективным и безопасным при назначении конкретному пациенту?
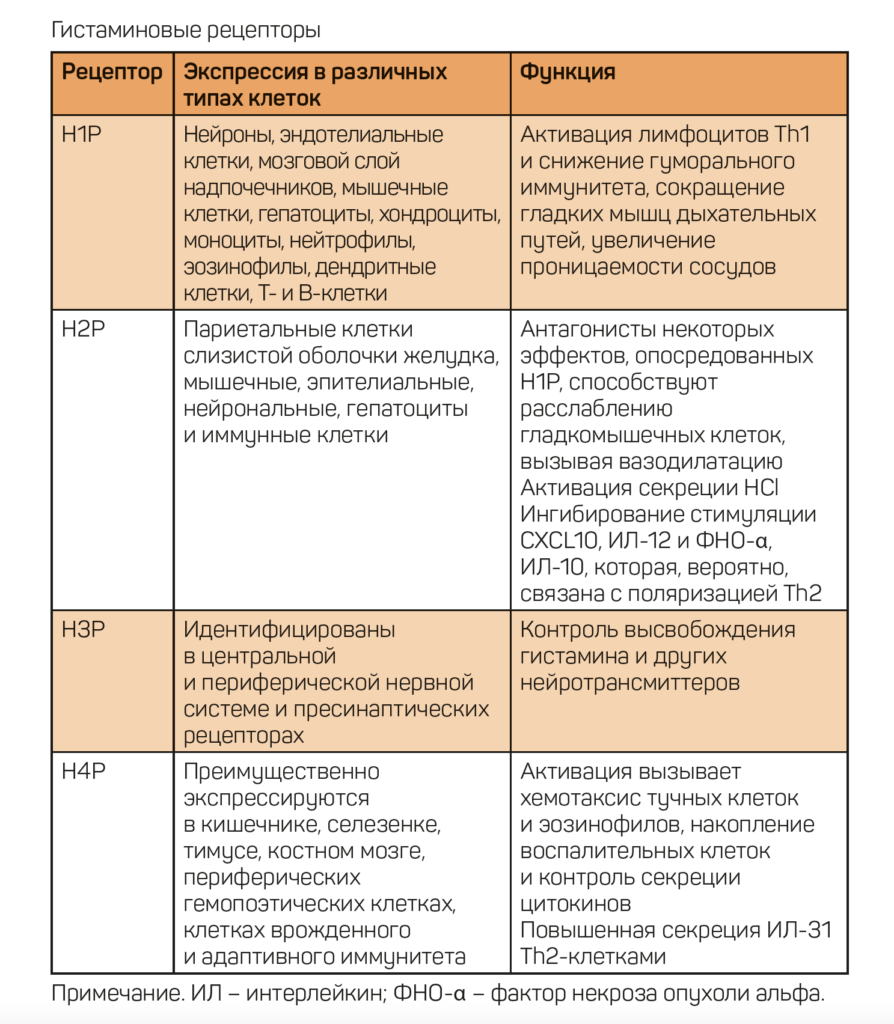
Гистамин и гистаминовые рецепторы
Зуд, вызванный действием гистамина, действует на сенсорные нейроны, которые воспринимают боль и зуд. Стимул передается в головной мозг, вызывая высвобождение нейромедиаторов [1]. Гистамин впервые синтезирован в 1907 г. немецкими химиками Виндаусом и Войтом. В 1936 г. сэр Генри Дейл получил Нобелевскую премию за обнаружение биологической активности гистамина [2].
В 1937 г. итальянским фармакологом Дэниэлом Боветом были разработаны АГП [3]. Только в 1942 г. первые препараты были использованы у людей: вначале фенбензамин, позже – мепирамин.
Гистамин – одна из самых хорошо изученных молекул. Он оказывает влияние почти на каждую систему органов через четыре различных подтипа рецепторов, связанных с белком G, которые были названы в хронологическом порядке их открытия [5]: рецептор Н1 (Н1P), Н2 (Н2Р), Н3 (Н3Р) и Н4 (Н4Р) [1, 6, 7].
- Учитывая широкий спектр действия гистамина, блокаторы гистаминовых рецепторов исследуют для лечения и других заболеваний:
- блокаторы Н1Р для уменьшения повреждение печени после тяжелых ожогов [12];
- Н2Р – лечения язвенной болезни и гастроэзофагеальном рефлюксе, в схемах лечения COVID-19 [6, 8];
- Н3Р – лечения нарколепсии [5];
- Н4Р – при атопическом дерматите, вестибулопатии и других патологических состояниях;
- блокаторы Н1Р-Н4Р – в лечении и профилактике мигрени [9]; для снижения риска некоторых типов рака [10, 11].
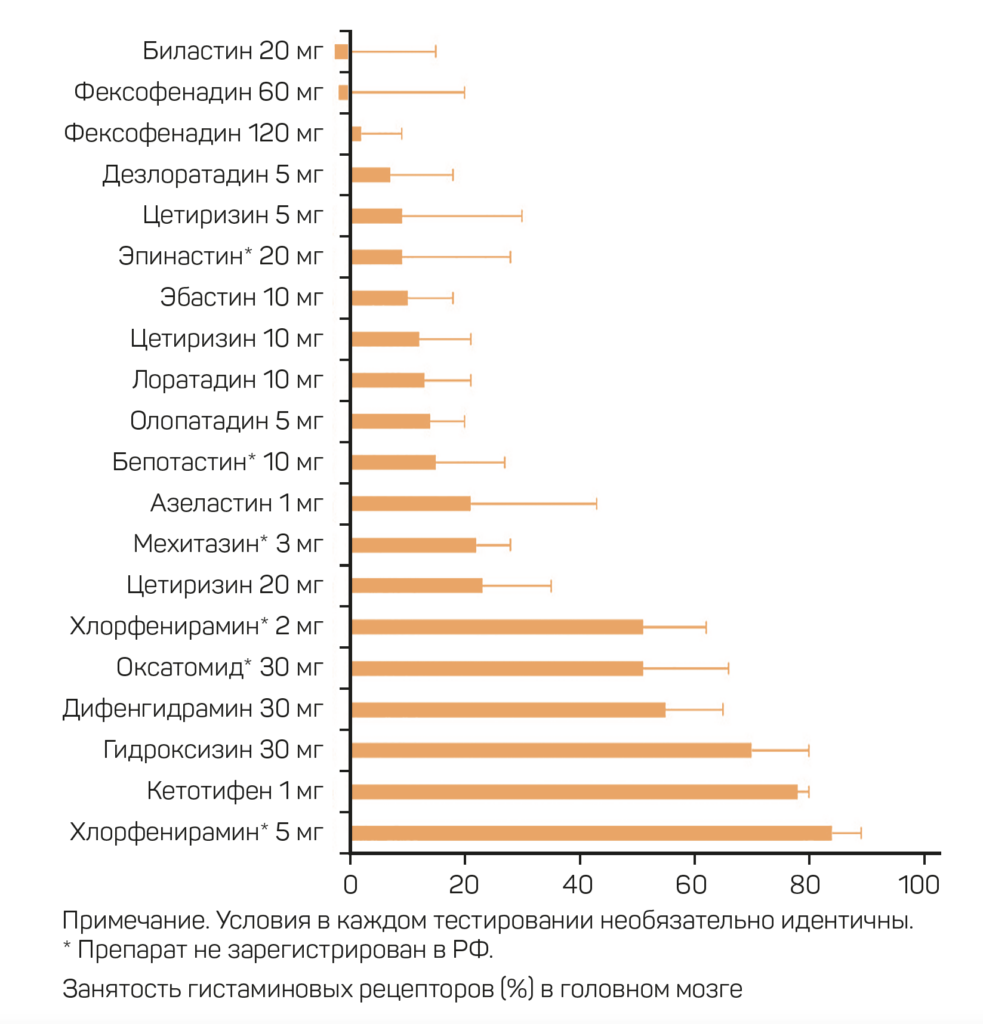
Выбор лекарственного препарата основывается на его эффективности и безопасности. Немаловажный аспект – влияние на работоспособность. Снижение работоспособности обусловлено седативным эффектом АГП.
Действие АГП классифицируется по занятости Н1-рецепторов (Н1Р) в головном мозг:
- 50% или более – седативное,
- 50–20% – умеренно седативное,
- 20% и менее – неседативное [3, 13].
Однако в клинической практике немало случаев, когда занятость Н1Р головного мозга не обязательно коррелирует с седацией. Это может быть связано с индивидуальной способностью каждого пациента метаболизировать препарат и разной фармакокинетикой [13].
При подборе АГП необходимо принимать во внимание индивидуальные особенности пациента, сопутствующие заболевания, влияние на работоспособность и профессию. Так, водителям и пилотам допустимо назначать только неседативные АГП [14, 15].
Седативные АГП или препараты I поколения
Самый известный АГП I поколения – дифенгидрамин (Димедрол) уже не отвечает современным требованиям безопасности и эффективности. Первые АГП характеризуются плохой селективностью к рецепторам и неспецифическим связыванием мускариновых, серотониновых и α-адренергических рецепторов, а также калиевых ионных каналов, что может вызывать потенциально опасные для жизни побочные эффекты. Способность легко проникать через гематоэнцефалический барьер может приводить к подавлению ЦНС и даже токсичности [16].
Известно, что прием АГП I поколения часто приводит к сонливости, усталости и нарушению концентрации внимания и памяти. Частота субъективно отмеченной сонливости варьирует от 40 до 80%. Остаточные явления, подобные похмелью, сохраняются и на следующее утро [17, 18].
Существует практика применения седативных АГП в качестве вспомогательных снотворных средств. Однако отмечают «неестественный» сон, изменение циркадного цикла «сон – бодрствование». Сон становится прерывистым, нарушается сердечный ритм и дыхание во сне (апноэ). Пациенты отмечают дневную сонливость, снижение работоспособности.
Помимо седативного действия, АГП I поколения имеют кратковременный эффект, что требует приема три раза в день. На фоне их приема быстро развивается тахифилаксия. АГП I поколения имеют низкую селективность к Н1-рецепторам, что обусловливает побочные эффекты: сухость слизистых, тахикардию, повышение вязкости мокроты, запор, тошноту и др. [7]. У пожилых людей могут возникать когнитивные нарушения, падения, спутанность сознания. Американское гериатрическое общество классифицирует их как «потенциально неподходящие» для применения у пожилых [19]. Седативные АГП также не рекомендуют детям [20].
Несмотря на недостатки, только АГП I поколения доступны для парентерального введения и назначаются:
- при анафилактическом шоке для уменьшения проницаемости капилляров, отека тканей, зуда и гиперемии [21];
- генерализованной крапивнице со стабильными показателями гемодинамики.
Неседативные АГП или препараты II поколения
Цетиризин, первый высокоизбирательный блокатор Н1Р на основе метаболита гидроксизина, получивший одобрение в 1987 г. [2], по-прежнему применяют у взрослых и детей, а также у беременных и кормящих [20].
Существует широкий выбор АГП II поколения: лоратадин, дезлоратадин, левоцетиризин, фексофенадин, рупатадин, эбастин, биластин.
Некоторые авторы выделяют дезлоратадин в III поколение АГП [25], однако такое разделение не является признанным.
АГП II поколения демонстрируют:
- высокую селективность к Н1-рецепторам;
- низкую проницаемость через гематоэнцефалический барьер [24];
- быстрое начало действия (как правило, в течение 30 минут при пероральном приеме);
- длительность эффекта, который сохраняется в течение суток и даже дольше;
- высокий профиль безопасности [26].
Важно наличие разнообразных форм препаратов: таблетки; назальные и глазные капли как в моно-, так и в комбинациях; сиропы и капли для перорального приема. Это делает применение удобным для разных возрастов и нозологий.
Многие аллергические заболевания требуют длительного приема АГП, а иногда увеличения доз до двух- и даже четырехкратных. В этих случаях их применяют off label. Согласно клиническим рекомендациям по крапивнице, при неэффективности стандартной дозы рассматривают ее увеличение до двукратной у детей и до четырехкратной у взрослых, сопоставляя пользу и риски [22].
Хифенадин – антигистаминный препарат НЕ I поколения
Хифенадин (Фенкарол) – АГП I поколения с характеристиками II.
Синтезирован в 1977 г. советскими учеными во главе с академиком М.Д. Машковским [29]. Несмотря на принадлежность к седативным АГП, хифенадин благодаря низкой липофильности плохо проникает через гематоэнцефалический барьер и не оказывает угнетающего влияния на ЦНС [30].
По данным исследований, седативный эффект при применении хифенадина отмечался у 1–40% пациентов, являлся дозозависимым и значительно уменьшался при снижении дозы препарата до средне терапевтической (25 мг три раза в день) [31, 32]. В одном из исследований получены результаты, демонстрирующие полное отсутствие седативного эффекта, т.е. сопоставимого с плацебо, при применении хифенадина [33].
Помимо блокады Н1Р, препарат блокирует 5-НТ1- серотониновые рецепторы, что значительно ослабляет действие основных медиаторов зуда – серотонина и гистамина [35].
В ряде исследований продемонстрирована высокая эффективность хифенадина, сопоставимая и даже превосходящая эффективность АГП II поколения:
- В исследовании пациентов c аллергодерматозами, одна группа которых получала хифенадин, а вторая – дезлоратадин, балльные оценки по шкале SCORAD (Scoring of Atopic Dermatitis) и балльная оценка зуда были ниже в группе хифенадина. Оценки качества жизни по опроснику DLQI (Dermatology Life Quolity Index) были достоверно выше у пациентов, принимавших хифенадин [36].
- Согласно результатам другого рандомизированного исследования, эффективность хифенадина была выше, чем лоратадина, у пациентов с сезонным аллергическим ринитом [37].
- Проведены исследования эффективности и безопасности хифенадина при лечении аллергических реакций на лекарственные препараты [38], лор-патологии [39], в том числе аллергического ринита в сочетании с бронхиальной астмой [40], атопического дерматита и других кожных заболеваний [35, 41], острой и хронической крапивницы [42, 43].
Преимущество инъекционной формы хифенадина (Фенкарола) продемонстрировано в сравнительном исследовании с клемастином (Тавегилом) у пациентов с крапивницей. В группе препарата Фенкарол уже на второй день терапии отмечались более выраженное снижение интенсивности зуда, меньшие размеры волдырей и менее выраженное нарушение сна. Кроме того, общая частота развития нежелательных явлений была статистически значимо выше в группе клемастина [42].
Одно из важнейших требований к АГП – продолжительность действия, которая обусловлена периодом полувыведения препарата. У хифенадина период полувыведения – 20 часов, что обеспечивает значительную продолжительность клинического эффекта [44]. Фенкарол характеризуется хорошей переносимостью и редким проявлением побочных эффектов, таких как сухость во рту, сонливость, которые присущи АГП I поколения [45].
На состоявшемся 7 июня 2023 г. совете экспертов, посвященном особенностям применения и определению места хифенадина в терапии аллергических заболеваний и классификации АГП, были сделаны следующие выводы: Выводы совета экспертов от 7 июня 2023 г. , посвященном особенностям применения и определению места хифенадина в терапии аллергических заболеваний и классификации АГП:
- доклинические и клинические исследования показывают, что седативный эффект хифенадина сопоставим с плацебо;
- активация диаминоксидазы (тканевой гистаминазы) – уникальное свойство, не описанное у других АГП. Это обеспечивает дополнительный противозудный и противоотечный эффект и обусловливает эффективность хифенадина у пациентов, у которых неэффективны другие АГП;
- препарат имеет высокий профиль безопасности: выраженность М-холинолитического побочного эффекта сравнима с другими АГП II поколения;
- не оказывает тератогенного, эмбриотоксического, кардиотоксического действий.
Хифенадин может быть рекомендован для терапии аллергодерматозов, в том числе сопровождающихся кожным зудом (крапивница, атопический дерматит, экзема и др.), а также для лечения аллергического ринита у взрослых. Наиболее часто используемая доза у взрослых 75–100 мг в сутки.
Хифенадин может быть рекомендован для терапии аллергодерматозов, в том числе сопровождающихся кожным зудом (атопический дерматит, крапивница и др.), а также для терапии поллиноза у детей старше 3 лет;
Наиболее часто используемая доза у детей 3-7 лет – 20 мг в сутки, 7-18 лет – 25–50 мг в сутки, что соответствует инструкции.
Хифенадин – единственный неседативный АГП в инъекционной форме для пациентов старше 18 лет при тяжелом течении аллергических реакций (крапивница, отек Квинке, поллиноз) [44].
Принимая во внимание все характеристики препарата хифенадин (метаболизм, профиль безопасности, эффективность, выраженность седативного эффекта, продолжительность действия), можно заключить, что он является первым представителем АГП нового поколения и был отнесен к I поколению хронологически, когда еще не существовали АГП II поколения.
Адаптировано из статьи Малышева М.В., Ненашева Н.М. Антигистаминные препараты из поколения в поколение. Практическая аллергология. 2023; 2.
Литература
1. Smolinska S., Winiarska E., Globinska A., Jutel M. Histamine: a mediator of intestinal disorders – a review. Metabolites. 2022; 12 (10): 895.
2. Ince M., Ruether P. Histamine and antihistamines. Intensive Care Med. 2021; 22 (11): 749–755.
3. Yanai K. Ideal antihistamine therapy from the viewpoint of pharmacological action. J. Otolaryngol. Jpn. 2019; 123: 196–204.
4. Sagayaraj Ravhe I., Krishnan A., Manoj N. Evolutionary history of histamine receptors: early vertebrate origin and expansion of the H3-H4 subtypes. Mol. Phylogenet. Evol. 2021; 154: 106989.
5. Tiligada E., Ennis M. Histamine pharmacology: from Sir Henry Dale to the 21st century. Br. J. Pharmacol. 2020; 177: 469–489.
6. Eldanasory O.A., Eljaaly K., Memish Z.A., Al-Tawfiq J.A. Histamine release theory and roles of antihistamine in the treatment of cytokines storm of COVID-19. Travel Med. Infect. Dis. 2020; 37: 101874.
7. Карева Е.Н. Выбор антигистаминного препарата: взгляд фармаколога. РМЖ. 2016; 12: 811–816.
8. Mashauri H.L. Covid-19 histamine theory: why antihistamines should be incorporated as the basic component in Covid-19 management? Health Sci. Rep. 2023; 6: e1109.
9. Ferretti A., Gatto M., Velardi M. et al. Migraine, allergy, and histamine: is there a link? J. Clin. Med. 2023; 12 (10): 3566.
10. Peng J.-Y., Yu Y.-H., Chen W.-M. et al. Association of antihistamine use with increased risk of esophageal squamous cell carcinoma: a nationwide, long-term follow-up study using propensity score matching. Biomedicines. 2023; 11 (2): 578.
11. Shen Y.C., Hsu H.C., Lin T.M. et al. H1-antihistamines reduce the risk of hepatocellular carcinoma in patients with hepatitis B virus, hepatitis C virus, or dual hepatitis B virus- hepatitis C virus infection. J. Clin. Oncol. 2022; 40 (11): 1206–1219.
12. Jizhuang W., Chenghao L., Xinying L. et al. Histamine H1 receptor antagonist attenuates catecholamine surge and organ injury after severe burns. Front. Endocrinol. 2023; 14: 1068925.
13. Fukasawa T., Yoshizaki-Ogawa A., Enomoto A. et al. Pharmacotherapy of itch – antihistamines and histamine receptors as G protein-coupled receptors. Int. J. Mol. Sci. 2022; 23 (12): 6579.
14. UK Civil Aviation Authority Guidance Material. Version 1.1. 01/2019. Available at: http://www.caa.co.uk/medical
15. Federal Aviation Administration. Does the FAA have a list of prescription and over-the-counter drugs that pilots can and cannot take while flying? Available at: https://www.faa.gov.
16. Fein M.N., Fischer D.A., O’Keefe A.W. et al. CSACI position statement: newer generation H1-antihistamines are safer than first-generation H1-antihistamines and should be the first-line antihistamines for the treatment of allergic rhinitis and urticaria. Allergy Asthma Clin. Immunol. 2019; 15: 61.