Значение зуда, патогенетические механизмы его формирования и оценка клинических проявлений при атопическом дерматите
О.Б. Тамразова
д-р мед. наук, профессор ФГАОУ ВО «Российский университет дружбы народов», г. Москва, ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
Е.А. Глухова
ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
Клиника ФГБУН «Федеральный исследовательский центр питания и биотехнологии», г. Москва
Университетская детская клиническая больница ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России
Н.Ф. Дубовец
ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
Л.В. Гончарова
ГБУЗ «Детская городская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы»
Рост распространенности атопического дерматита среди детей формирует глобальную медико-социальную проблему. Заболевание может протекать с разной клинической картиной, однако обязательным для всех пациентов симптомом является зуд, оказывающий значительное влияние на качество жизни пациента и его семьи. Патофизиология зуда при атопическом дерматите многогранна и включает в себя передачу нервного импульса по нейронным путям в головной мозг, разрастание нервных волокон в коже, синтез медиаторов зуда (пруритогенов) кератиноцитами, иммунными клетками и нервными окончаниями. Пруритогены в большинстве случаев оказывают как прямое, так и опосредованное действие на нейроны путем усиления экспрессии провоспалительных цитокинов. В данной статье рассматриваются наиболее сильные пруритогены (гистамин, серотонин, интерлейкин-31 и т. д.), клинические проявления зуда при атопическом дерматите, а также основные принципы терапии данного симптома.
Ключевые слова: атопический дерматит, зуд, гистамин, серотонин, нервные окончания, хифенадин, Фенкарол®.
Введение
В последние десятилетия наблюдается неуклонный рост распространенности атопического дерматита (АтД). Такая тенденция, характерная для стран с развитой промышленностью, высоким уровнем экономики, а также для быстроразвивающихся стран, формирует глобальную медико-социальную проблему для мирового здравоохранения1-3. АтД – мультифакторное заболевание с хроническим течением, в основе которого лежит генетическая предрасположенность к атопическим заболеваниям, дисрегуляция иммунного ответа, нарушение кожного барьера и влияние факторов окружающей среды. Сложный, неоднородный, многоуровневый патогенетический механизм АтД обусловливает тенденцию к выделению эндотипов заболевания, а также отсутствие специфических биомаркеров, указывающих на наличие АтД и его тяжесть4, 5, поэтому диагноз АтД является клиническим. Наиболее часто врачи в своей практике применяют диагностические критерии J.M. Hanifin и G. Rajka, которые включают 4 основных и 23 второстепенных признака6.
Зуд (лат. pruritis) – обязательный диагностический критерий АтД. Это неприятное ощущение раздражения, жжения и покалывания на участке кожи, возникающее по различным причинам. Зуд можно описать и как особое неприятное ощущение, вызывающее потребность почесаться. Интенсивность зуда может быть различной – от слабой до выраженной. Зуд, приводящий к нарушению сна, расценивается как тяжелый. Особой формой считается биопсирующий зуд – сильный зуд, при котором расчесывание кожи приводит к сильным ее повреждениям (рис. 1)7, 8.
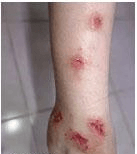
Рис. 1. В результате расчесов образуются множественные папулы, в центре которых располагаются эрозии или геморрагические корочки.
В норме зуд является защитным механизмом, направленным на удаление с ее поверхности раздражителя путем механических движений – почесываний9. Но при АтД зуд носит патологический характер и сильно ухудшает качество жизни человека. Атопический зуд ассоциирован с развитием хронического стресса, психических расстройств и повышенным риском появления суицидальных мыслей. Доказано, что хронический стресс является не только следствием, но и причиной зуда, замыкая таким образом порочный круг. Данные характеристики особенно актуальны для подростков и взрослых лиц10. По некоторым данным, у 2/3 пациентов зуд также приводит к нарушению сна, что в детской популяции ассоциировано с синдромом дефицита внимания, плохой успеваемостью, низкой самооценкой и отрицательным влиянием на социальную жизнь11-13. Зуд при АтД всегда сопровождается экскориациями, результатом которых могут стать рубцы и рубцовая атрофия кожи (рис. 2).
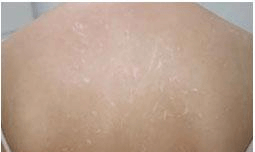
Рис. 2. Множественные линейные рубцы на коже спины у пациента с атопическим дерматитомрочки.
Выраженность зуда коррелирует с тяжестью течения АтД и других хронических аллергодерматозов, а динамическое наблюдение за данным симптомом позволяет судить об эффективности терапии. Это нашло отражение в оценочных шкалах АтД:
- индекс тяжести и распространенности экземы (Eczema Area and Severity Index), с помощью которого врач оценивает зуд по наличию и характеру экскориаций;
- шкала оценки выраженности зуда (Numeric Rating Scale);
- шкала оценки степени тяжести атопического дерматита (Scoring of Atopic Dermatitis), по которой пациент, основываясь на субъективных ощущениях, оценивает выраженность зуда по 10-балльной шкале14.
Таким образом, механизмы возникновения пруритоцептивных ощущений очень сложны и во многом носят индивидуальный характер, а сама проблема зуда занимает особое место среди терапевтических задач при ведении больных с АтД: ее решение приводит не только к регрессу внешних клинических проявлений заболевания, но и к значительному улучшению качества жизни больного и его семьи.
Молекулярные основы зуда
За последнее десятилетие были достигнуты огромные успехи в понимании механизмов развития зуда. В передаче сенсорной информации от рецепторов зуда к спинному мозгу выделяют два основных афферентных пути: гистаминергический и негистаминергический.
Гистаминергический путь в основном опосредован немиелинизированными, механонечувствительными С-волоконами, которые реагируют на гистамин, тогда как негистаминергический путь включает поли-модальные механо- и теплочувствительные С-волокна и Ad-волокна15. Помимо передачи нервного импульса возбужденные свободные нервные окончания реципрокно и опосредованно активируют первичные афферентные нейроны путем высвобождения нейропептидов, которые в свою очередь стимулируют дегрануляцию тучных клеток и синтез провоспалительных цитокинов Тh2-клетками, т. е. увеличивают количество медиаторов зуда16. Более того, само почесывание, вызванное ощущением зуда, приводит к еще большему повреждению кожного барьера, запуская цикл зуд -> расчес -> воспаление (рис. 3). Следовательно, продукция медиаторов зуда, или, иначе, пруритогенов, является и причиной, и следствием АтД17.
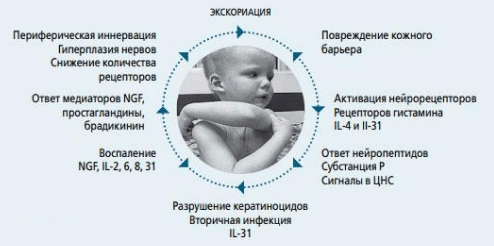
Рис. 3. Цикл зуд -расчес – воспаление
В зависимости от пути передачи нервного импульса принято разделять пруритогены на:
- гистаминзависимые: гистамин, фактор активации тромбоцитов, серотонин и др.;
- гистаминнезависимые: протеазы (триптаза, калликреин, катепсин 5), тимический стромальный лимфопоэтин (TSLP), интерлейкины (ИЛ-31, ИЛ-33, ИЛ-6, ИЛ-4 и ИЛ-13), нейротрофины (фактор роста нервов, нейротрофический фактор головного мозга и др.), нейропептиды (субстанция P, пептид, связанный с геном кальцитонина, и вазоактивный интестинальный пептид) и др.18
С целью определения терапевтических мишеней следует обозначить молекулярные механизмы действия основных пруритогенов.
Гистамин – самый изученный пруритоген, который в организме высвобождается в результате дегрануляции тучных клеток и базофилов во время аллергического воспаления и взаимодействует с эффекторными клетками путем связывания с одним из четырех рецепторов (H1R-H4R)19. При этом в патогенезе зуда участвуют два рецептора: H1R играет значительную роль в возникновении острого зуда, например при крапивнице; H4R преимущественно экспрессируется в иммунных клетках, а также в кератиноцитах и сенсорных нейронах и участвует в основном в патогенезе хронического зуда20, 21. Продемонстрировано, что уровень экспрессии мРНК H1R и H4R в кератиноцитах у пациентов с АтД выше, чем у пациентов с псориазом и здоровых людей22. Помимо прямого действия на рецепторы зуда, гистамин опосредованно поддерживает воспаление кожи, регулируя синтез и выделение клетками некоторых цитокинов и пруритогенов (ацетилхолина, серотонина, TSLP, ИЛ-31, онкостатина M) либо выступая в роли конечных молекул-эффекторов, обусловленных действием других пруритогенов (например, субстанции Р)23-25.
Серотонин, или 5-гидрокситриптамин, – мощный индуктор как острого, так и хронического зуда, что объясняется связыванием с рецептором HTR7, расположенным на сенсорных нейронах кожи, и дальнейшей активацией ионных каналов TRPA1 мембран клеток, ответственных за негистаминергический афферентный путь передачи импульса. Такая реализация сигнала приводит к зуду не только при АтД, но и при других аллергодерматозах, псориазе, а также уремии и холестазе. Кроме того, повышенный уровень серотонина также ассоциирован с проявлениями астмы при атопических заболеваниях26.
Протеазы поддерживают воспаление кожи, оказывая, с одной стороны, прямое протеолитическое действие на корнеодесмосомы и плотные контакты, тем самым усиливая проницаемость эпидермального барьера, а с другой стороны, связываясь с рецептором PAR2, представленным на поверхности кератиноцитов и сенсорных нервных окончаний. В первом случае протеазы стимулируют выработку пруритогена TSLP, во втором – активируют негистаминергический зуд27. Протеазы могут быть как эндогенного, так и экзогенного происхождения (например, они могут вырабатываться клещами, обитающими в домашней пыли, грибками, стафилококками)28. При осложненных вторичной инфекцией формах АтД наибольшую роль в формировании зуда играют протеазы золотистого стафилококка.
Тимический стромальный лимфопоэтин (TSLP) экспрессируется в эпителиальных клетках, кератиноцитах и эпителиоцитах дыхательных путей, что дало основание говорить о его активной роли в прогрессировании «атопического марша» – последовательного развития нескольких заболеваний – от АтД до бронхиальной астмы. В патогенезе АтД под действием TSLP активируются различные иммунные клетки, включая дендритные клетки, Т-клетки, В-клетки, естественные Т-киллеры, тучные клетки, базофилы и эозинофилы, которые секретируют провоспалительные цитокины, в том числе медиаторы зуда. Помимо косвенной стимуляции зуда, TSLP непосредственно активирует сенсорные нейроны кожи29.
Интерлейкин-31 продуцируется Т-хелперами 2-го типа, макрофагами, дендритными клетками, тучными клетками, базофилами и эозинофилами под действием ИЛ-4, ИЛ-33, стафилококкового энтеротоксина В и стафилококкового а-токсина. Рецептор ИЛ-31 имеет гетеродимерное строение и располагается на мембранах сенсорных нейронов, макрофагах, дендритных клетках, базофилах и эпителиальных клетках, включая кератиноциты, обусловливая прямое и опосредованное действие на развитие хронического зуда у пациентов с АтД30. Кроме того, ИЛ-31 может способствовать экспрессии генов роста сенсорных нейронов, активации нейронов, их удлинению и ветвлению, что усиливает гиперчувствительность кожи при АтД31.
Также ИЛ-31 ингибирует дифференцировку кератиноцитов путем подавления экспрессии структурных белков, таких как филаггрин, инволюкрин и цитокератин 10, что приводит к ремоделированию эпидермиса и нарушению его барьерной функции32.
Субстанция P относится к группе нейропептидов, т. е. белков, высвобождаемых из нервных окончаний. Она передает сигнал в основном с помощью рецептора нейрокинина 1 (NK1R), который экспрессируется на нейронах в центральной и периферической нервной системе, а также на кератиноцитах, тучных клетках и других иммунных клетках. В дополнение к NK1R, субстанция P может связываться с Mas-родственными рецепторами, связанными с G-белком, которые участвуют в ноцицепции и передаче сигналов зуда. Субстанция P является важным нейровоспалительным медиатором, который может стимулировать экспрессию и высвобождение различных цитокинов, активируя Т-клетки, дендритные клетки и эозинофилы. Она также может индуцировать дегрануляцию тучных клеток и высвобождение гистамина, лейкотриена B4, простагландина D2, фактора некроза опухоли а, фактора роста эндотелия сосудов и ИЛ-133.
Атопический зуд в клинической практике
Для АтД характерно разрастание нервных окончаний в эпидермисе, что способствует гиперсенситизации кожи к факторам внешней среды даже при отсутствии признаков воспаления (рис. 4)34, например, зуд кожи возникает при контакте с шерстяной одеждой или при касании челкой кожи лба.
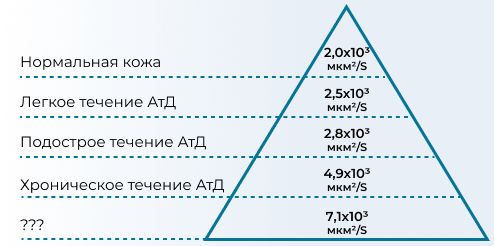
Рис. 4. Пролиферация чувствительных нервных окончаний при аллергодерматозах, выраженная в отношении площади, занимаемой нервными окончаниями на изучаемом участке кожи (мкм2) к площади этого участка (мм2)35
Наличие ксероза кожи усугубляет данный процесс, с одной стороны «оголяя» нервные окончания, с другой – способствуя пенетрации чужеродных агентов. Клинически это проявляется как сухая кожа с мелкопластинчатым шелушением на поверхности и линейными экскориациями (рис. 5). В таких случаях необходимо использовать большое количество питательных средств; возможно, потребуется консультация психоневролога с целью исключения патомимии.
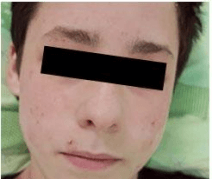
Рис. 5. Мальчик, 15 лет. Атопический дерматит, эритематозно-сквамозная форма. Ксероз кожи. На фоне сухости кожи наблюдаются геморрагические корочки и экскориации.
Вторичное инфицирование золотистым стафилококком (S. aureus) приводит к эскалации Th2-воспаления и значительному усилению зуда. В частности, такие токсины S. aureus, как а-токсин и энтеротоксин B, способны индуцировать мощную секрецию Т-клетка-ми пруритогена ИЛ-3136. Клинические проявления вторичного инфицирования – эритематозно-сквамозные очаги, усиление мокнутия, появление серозно-гнойных корок, четких границ (рис. 6).
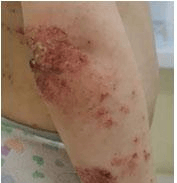
Рис. 6. Девочка, 6 лет. Атопический дерматит, эритематозно-сквамозная форма, вторичное инфицирование. Ярко-розовые эритематозно-сквамозные очаги округлой формы с четкими границами и геморрагическими корочками на поверхности
У подростков и взрослых с АтД нередко наблюдается дерматит кожи головы и шеи, т. е. дерматит себорейных зон, где наиболее велико количество сальных желез и происходит колонизация грибами рода Malassezia spp. как представителем нормальной микробиоты. Однако у пациентов с дерматитом кожи головы и шеи развивается сенсибилизация к Malassezia spp. Кроме того, сам грибок способен индуцировать провоспалительный ответ, взаимодействуя с кератиноцитами, клетками Лангерганса, дендритными клетками, естественными киллерами и фибробластами37. При такой клинической форме АтД наблюдаются очаги гиперемии на коже лица, шеи, возможно мелкопластинчатое шелушение и усиление зуда (рис. 7).
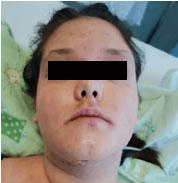
Рис. 7. Девочка, 14 лет. Атопический дерматит, эритематозно-сквамозная форма с лихенификациями, среднетяжелое течение, обострение. В области лица, шеи – множественные бледно-розовые эритемы с четкими границами с тенденцией к слиянию, на поверхности которых – мелкопластинчатое шелушение. На коже подподобородочной области – геморрагические корочки.
Выраженный зуд также характерен для лихеноидной формы АтД, при которой в области локтевых сгибов, подколенных ямок и, реже, на коже шеи, подмышечных впадин, подъягодичных складок образуются лихенификации, т. е. уплотнение кожи с выраженным кожным рисунком, обильными экскориациями, геморрагическими корочками, трещинами, располагающимися на фоне эритематозных очагов (рис. 8).
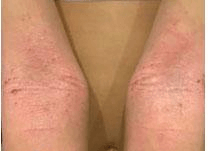
Рис. 8. Девочка, 10 лет. Атопический дерматит, эритематозно-сквамозная форма с лихенификациями, среднетяжелое течение. На коже локтевых сгибов – бледно-розовые лихенификации без четких границ, в пределах очагов – геморрагические корочки.
Пруригинозная (узловая) форма АтД ассоциирована с биопсирующим зудом, т. е. зудом, который приводит к разрушению нервных окончаний в очагах поражения. Интересно, что именно при этой форме в очагах поражений наблюдаются наибольшая плотность нервных волокон и повышенная экспрессия пруритогена ИЛ-31, инфильтрат клеток состоит преимущественно из лимфоцитов, нейтрофилов, тучных клеток и иногда эозинофилов38. У пациентов наблюдаются папулы, как правило на коже конечностей, с геморрагическими корочками на поверхности (как результат расчесов) (рис. 9).
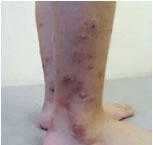
Рис. 9. Мальчик, 13 лет. Атопический дерматит, пруригинозная форма, среднетяжелое течение. На коже голеней – множественные розовые плотные папулы, на поверхности которых геморрагические корочки.
Принципы терапии
Ввиду сложного многокомпонентного характера атопического воспаления терапия АтД должна быть комплексной и направленной сразу на несколько патогенетических мишеней. Безусловно, восстановление эпидермального барьера путем ежедневного применения эмолентов является неотъемлемой частью лечения вне зависимости от стадии и степени тяжести кожного процесса. Кроме того, для длительной терапии можно применять средства лекарственной косметики, в состав которых входят молекулы, блокирующие рецепторы сенсорных нейронов: ментол, топические анестетики (прамоксин, полидоканол и др.), капсаицин39.
Препаратами первой линии при наличии воспаления являются топические глюкокортикостероиды – универсальные противовоспалительные средства, значительно снижающие уровень зуда, оказывающие выраженное сосудосуживающее, антипролиферативное и противоаллергическое действие на биохимическом, молекулярном и клеточном уровне40.
Топические ингибиторы кальциневрина следует применять в качестве препаратов второй линии. Они показаны для длительной терапии, а также при поражении областей с «тонкой» кожей (лицо, складки и область гениталий). В период ремиссии такролимус необходимо использовать в качестве проактивной терапии (наносить на области тела, где наблюдалось наиболее интенсивное поражение в ходе последнего обострения или где воспаление присутствует всегда, например на кожу локтевых сгибов и подколенных ямок). Механизм действия препаратов основан на ингибировании белка кальциневрина, который регулирует транслокацию цитозольных компонентов нуклеарного фактора активированных лимфоцитов в ядро, тормозя экспрессию медиаторов воспаления41.
При тяжелых и среднетяжелых формах заболевания согласно клиническим рекомендациям по лечению АтД показана системная терапия инъекционными глюкокортикостероидами, фототерапия либо генноинженерная биологическая терапия42. Ввиду большого количества серьезных побочных эффектов терапия инъекционными глюкокортикостероидами ограничена по времени и режиму дозирования. Фототерапия является трудоемким методом лечения, так как требует наличия оборудования, обученного персонала и длительного пребывания пациента в условиях стационара.
Дупилумаб – первый генно-инженерный биологический препарат, направленный на блокирование общей субъединицы рецепторов ИЛ-4 и ИЛ-13, ключевых цитокинов Th2-воспаления при АтД. Препарат обладает хорошим профилем безопасности и высокой эффективностью: уже к 12-й неделе применения наблюдается регресс кожных проявлений, снижение выраженности зуда и улучшение качества сна. Нельзя не отметить высокую стоимость терапии и низкую доступность43.
Упадацитиниб – селективный ингибитор янус-киназы 1, являющейся частью внутриклеточной сигнальной системы JAK-STAT. Препарат модулирует иммунные ответы Т-хелперов. Блокирование янус-киназы 1 делает невозможной передачу сигнала от медиаторов воспаления АтД (ИЛ-4, ИЛ-13, ИЛ-22, TSLP и т. д.), что приводит к регрессу клинических проявлений, в том числе зуда44.
Препарат «Фенкарол»® (МНН – хифенадин) показан взрослым и детям старше 3 лет при множестве заболеваний, сопровождающихся зудом: поллинозе (сезонном аллергическом риноконъюнктивите), экземе, атопическом дерматите, острой и хронической крапивнице, ангионевротическом отеке, псориазе, кожном зуде52.
Рекомендованные дозировки, согласно инструкции к препарату:
Детям:
- от 3 до 7 лет – по 1 таб. 10 мг 2 раза в день,
- от 7 до 12 лет – по 1 таб. 10 мг 2-3 раза в день,
- старше 12 лет – по 1 таб. 25 мг 2-3 раза в день.
Взрослым:
- «Фенкарол»® назначается в дозировке 50 мг 1-4 раза в день.
Однако нередко в клинической практике наблюдаются случаи, когда наружной терапии недостаточно, а системная иммуносупрессивная терапия будет излишней. Тогда возможно рассмотреть вопрос о назначении антигистаминной терапии в комбинации с топическими противовоспалительными препаратами. Антигистаминные препараты, нацеленные на блокирование действия сильнейшего пруритогена – гистамина, в данном случае позволят разорвать цикл зуд -> расчес -> воспаление, что будет способствовать восстановлению кожного барьера и усилению действия местной терапии. Кроме того, согласно клиническим рекомендациям по ведению пациентов с АтД в случаях, когда у детей со среднетяжелым и тяжелым течением имеются сопутствующие аллергические заболевания (аллергический риноконъюнктивит, аллергическая крапивница, пищевая аллергия), в состав комплексной терапии следует включать антигистаминные препараты, при этом предпочтение стоит отдавать препарату, действие которого направлено сразу на несколько звеньев патогенеза зуда, для достижения оптимального клинического результата42.
Хифенадин – антигистаминный препарат, производное хинуклидина – молекулы, выделенной из коры хинного дерева. Хинуклидины – азотсодержащие гетероциклические молекулы, состоящие из двух конденсированных в положении 1,4-пиперидиновых циклов45. Уникальность данного лекарственного средства заключается в сочетании преимуществ антигистаминных препаратов 1-го и 2-го поколений, воздействия на различные механизмы зуда при АтД, наличия как пероральных, так и парентеральных форм, а также высоком профиле безопасности. Производные хинуклидина снижают содержание эндогенного гистамина на 30% в тканях путем активации фермента диаминоксидазы (гистаминазы), кроме того, хифенадин ингибирует активность не только Н1-рецептора гистамина, но и 5-НТ1-серотониновых рецепторов, тем самым блокируя связанные с рецептором ионные каналы TRP, осуществляющие передачу нервного импульса. Таким образом, хифенадин подавляет активность мощных пруритогенов – гистамина и серотонина, оказывая выраженный противозудный эффект46. Низкая липофильность молекулы хифенадина обусловливает невозможность проникновения препарата через гематоэнцефалический барьер. Эта особенность устраняет основные нежелательные эффекты антигистаминной терапии 1-го поколения – седативный и снотворный, что дает возможность назначать препарат пациентам с АтД без вреда для их повседневной активности47-49. Также хифенадин не обладает кардиотоксическим (проаритмогенным), М-холинолитическим и адренолитическим действием, т. е. не провоцирует сухость слизистых оболочек полости рта, носа, горла, бронхов, расстройства мочеиспускания и гипотензию50, 51.
Заключение
Кожный зуд при АтД – обязательный и самый изнуряющий симптом заболевания, который является как следствием атопического воспаления, так и его причиной, формируя порочный круг зуд -> расчес -> воспаление -> зуд. Патогенетические механизмы зуда лежат в плоскости многокомпонентного взаимодействия медиаторов зуда, пруритогенов, и сенсорных нервных окончаний. Действие наиболее важных пруритогенов (гистамина, серотонина, интерлейкинов и др.), как правило, направлено не только на передачу сигнала в спинной мозг путем генерации нервного импульса, но и на потенцирование экспрессии иммунными клетками, кератиноцитами провоспалительных цитокинов и их высвобождения, а также разрастание нейронной сити. Сложность патогенеза атопического зуда требует комплексного подхода с применением топической и системной терапии. Хифенадин («Фенкарол»®) – уникальный антигистаминный препарат, рекомендованный для лечения АтД, обладающий выраженным противозудным действием за счет блокады гистаминового и серотонинового рецепторов и активации протеазы эндогенного гистамина.
Список литературы:
* Все фотографии, представленные в статье, опубликованы с согласия законных представителей пациентов.
1. The International Study of Asthma and Allergies in Childhood (ISAAC) phase three: a global synthesis / J. Mallol [et al.] // Allergologia et Immunopathologia. 2013. Vol. 41, No. 2. P. 73-85.
2. Investigating international time trends in the incidence and prevalence of atopic eczema 1990-2010: A systematic review of epidemiologic studies / I.A. Deckers [et al.] // PLoS One. 2012. Vol. 7, No. 7.
3. Kowalska-Oledzka E., Czarnecka M., Baran A. Epidemiology of atopic dermatitis in Europe // Journal of Drug Assessment. 2019. Vol. 8, No. 1. P. 126-128.
4. Predicting persistence of atopic dermatitis in children using clinical attributes and serum proteins / F. Lauffer [et al.] // Allergy. 2021. Vol. 76, No. 4. P. 1158-1172.
5. Biomarkers in atopic dermatitis-a review on behalf of the International Eczema Council / Y. Renert-Yuval [et al.] // Journal of Allergy and Clinical Immunology. 2021. Vol. 147, No. 4. P. 1174-1190.e1.
6. Hanifin J.M., Rajka G. Diagnositic features of atopic dermatitis // Acta Dermato-Venereologica (Stockholm). 1980. Vol. 92, Suppl. P. 44-47.
7. The burden of atopic dermatitis: summary of a report for the National Eczema Association / A.M. Drucker [et al.] // Journal of Investigative Dermatology. 2017. Vol. 137, No. 1. P. 26-30.
8. Avena-Woods C. Overview of atopic dermatitis // American Journal of Managed Care. 2017. Vol. 23, No. 8, Suppl. P. S115-S123.
9. The Challenge of Basic Itch Research / E. Carstens, T. Follansbee, M. Iodi Carstens // Acta Dermato-Venereologica. 2020. Vol. 100, No. 2.
10. Suicidal ideation, mental health problems, and social function in adolescents with eczema: a population-based study / J.A. Halvorsen [et al.] // Journal of Investigative Dermatology. 2014. Vol. 134, No. 7. P. 1847-1854.
11. Illness perception in individuals with atopic dermatitis / A. Wittkowski, H.L. Richards, C.E. Griffiths, C.J. Main // Psychology, Health & Medicine. 2007. Vol. 12, No. 4. P. 433-444.
12. Hanifin J.M., Reed M.L. A population-based survey of eczema prevalence in the United States // Dermatitis. 2007. Vol. 18, No. 2. P. 82-91.
13. Eczema, sleep, and behavior in children / D. Camfferman [et al.] // Journal of Clinical Sleep Medicine. 2010. Vol. 6, No. 6. P. 581-588.
14. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis / L.F. Eichen-field [et al.] // Journal of the American Academy of Dermatology. 2014. Vol. 70, No. 2. P. 338-351.
15. Stander S., Yosipovitch G. Substance P (SP) and neurokinin 1 receptor (NK 1R) are new targets for the treatment of chronic pruritus // British Journal of Dermatology. 2019.
16. Kabata H., Artis D. Neuro-immune crosstalk and allergic inflammation // Journal of Clinical Investigation. 2019. Vol. 129. P. 1475-1482.
17. Kabashima K. New concept of the pathogenesis of atopic dermatitis: interplay among the barrier, allergy, and pruritus as a trinity / Journal of Dermatological Science. 2013. Vol. 70. P. 3-11.
18. Wong L.-S., Yen Y.-T., Lee C.-H. The Implications of pruritogens in the pathogenesis of atopic dermatitis // International Journal of Molecular Sciences. 2021. Vol. 22, No. 13. P. 7227.
19. Simons F.E., Simons K.J. Histamine and H1-antihistamines: celebrating a century of progress / Journal of Allergy and Clinical Immunology. 2011. Vol. 128. P 1139-1150.
20. Ohtsu H., Seike M. Histamine and histamine receptors in allergic dermatitis // Handbook of Experimental Pharmacology. 2016. Vol. 241. P 333-345.
21. The histamine H4 receptor is functionally expressed on neurons in the mammalian CNS / W.M. Connelly [et al.] // British Journal of Pharmacology. 2009. Vol. 157. P. 55-63.
22. Histamine induces proliferation in keratinocytes from patients with atopic dermatitis through the histamine 4 receptor / F. Glatzer [et al.] // Journal of Allergy and Clinical Immunology. 2013. Vol. 132. P 1358-1367.
23. The histamine H4 receptor is functionally expressed on Th2 cells / R. Gutzmer [et al.] // Journal of Allergy and Clinical Immunology. 2009. Vol. 123. P 619-625.
24. Stimulation of the histamine 4 receptor upregulates thymic stromal lymphopoietin (TSLP) in human and murine keratinocytes / K. Schaper [et al.] // Pharmaceutical Research. 2016. Vol. 113. P 209-215.
25. Histamine up-regulates oncostatin M expression in human M1 macrophages / S. Mommert [et al.] // British Journal of Pharmacology. 2020. Vol. 177. P 600-613.
26. HTR7 mediates serotonergic acute and chronic itch / T. Morita [et al.] // Neuron. 2015. Vol. 87, No. 1. P 124-138.
27. Lee S.E., Jeong S.K., Lee S.H. Protease and protease-activated receptor-2 signaling in the pathogenesis of atopic dermatitis / Yonsei Medical Journal. 2010. Vol. 51. P 808.
28. Ramachandran R., Hollenberg M.D. Proteinases and signalling: pathophysiological and therapeutic implications via PARs and more // British Journal of Pharmacology. 2008. Vol. 153. P S263-S282.
29. The epithelial cell-derived atopic dermatitis cytokine TSLP activates neurons to induce itch / S.R. Wilson [et al.] // Cell. 2013. Vol. 155, No. 2. P 285-295.
30. Furue M., Furue M. Interleukin-31 and pruritic skin // Journal of Clinical Medicine. 2021. Vol. 10, No. 9. P 1906.
31. The pruritus- and Th 2-associated cytokine IL-31 promotes growth of sensory nerves / M. Feld [et al.] // Journal of Allergy and Clinical Immunology. 2016. Vol. 138. P. 500-508.
32. IL-31 regulates differentiation and filaggrin expression in human organotypic skin models / C. Cornelissen [et al.] // Journal of Allergy and Clinical Immunology. 2012. Vol. 129. P. 426-433.
33. Neuropeptide substance P and the immune response / A. Mashaghi [et al.] // Cellular and Molecular Life Sciences. 2016. Vol. 73. P 4249-4264.
34. Density and fine structure of peripheral nerves in various skin lesions of atopic dermatitis / H. Sugiura [et al.] // Archives of Dermatological Research. 1997. Vol. 289, No. 3. P. 125-131.
35. Pautrier L.M. A propos de la maladie de Besnier-Boeck-Schaumann a forme de prurigo [Besnier-Boeck-Schaumann’s disease of prurigo type] // Annales de dermatologie et de syphiligraphie (Paris). 1954. Vol. 81, No. 5. P 481-490.
36. Kasraie S., Niebuhr M., Werfel T. Interleukin (IL)-31 induces pro-inflammatory cytokines in human monocytes and macrophages following stimulation with staphylococcal exotoxins // Allergy. 2010. Vol. 65. P 712-721.
37. The Kole of Malassezia spp. in atopic dermatitis / M. Glatz, PP Bosshard, W Hoetzenecker, P Schmid-Grendelmeier // Journal of Clinical Medicine. 2015. Vol. 4, No. 6. P 1217-1228.
38. Weigelt N., Metze D., Stander S. Prurigo nodularis: systematic analysis of 58 histological criteria in 136 patients // Journal of Cutaneous Pathology. 2010. Vol. 37, No. 5. P. 578-586.
39. Круглова Л. С., Переверзина Н. О., Коваленко Ю.А. Противозудная терапия как основная составляющая повышения качества жизни пациентов с дерматозами // Медицинский алфавит. 2020. № 6. С. 6-10.
40. Topical corticosteroids in dermatology / A.B. Mehta [et al.] // Indian Journal of Dermatology, Venereology and Leprology. 2016. Vol. 82, No. 4. P 371-378.
41. Carr WW Topical calcineurin inhibitors for atopic dermatitis: review and treatment recommendations / Paediatric Drugs. 2013. Vol. 15, No. 4. P 303-310.
42. Атопический дерматит. Федеральные клинические рекомендации. М., 2021. 84 с.
43. Laboratory safety of dupilumab in moderate-to-severe atopic dermatitis: results from three phase III trials (LIBERTY AD SOLO 1, LIBERTY AD SOLO 2, LIBERTY AD CHRONOS) / A. Wollenberg // British Journal of Dermatology. 2020. Vol. 182, No. 5. P 1120-1135.
44. Upadacitinib in adults with moderate to severe atopic dermatitis: 16-week results from a randomized, placebocontrolled trial / E. Guttman-Yassky [et al.] // Journal of Allergy and Clinical Immunology. 2020. Vol. 145. P. 877-884.
45. Яхонтов Л.Н., Михлина Е.Е. // Химия гетероциклических соединений. 1975. № 8. С. 1011-1025.
46. Машковский М.Д., Мутина Е.С., Каминка М.Э. Фенкарол и его применение в терапии аллергических заболеваний // Клиническая медицина. 1978. № 11. С. 22-28.
47. Феденко Е.С. Фенкарол в комплексной терапии атопического дерматита и хронической крапивницы // Аллергия, астма и клиническая иммунология. 2003. № 6. С. 10-12.
48. Лечение атопического дерматита в острый период / С.Н. Недель-ская [и др.] // Укр. журн. дерматологи, венерологи, косметологи. 2008. № 3. С. 64-67.
49. Перламутров Ю.Н., Ольховская К.Б. Переносимость и эффективность сехифенадина (гистафена) в комплексной терапии больных истинной экземой // Клиническая дерматология и венерология. 2009. № 3. С. 46-48.
50. Лусс Л.В., Шартанова Н.В. Антигистаминные препараты – производные хинуклидина – при аллергических заболеваниях. В чем преимущество? // Терапевтический архив. 2013. Т 85, № 1. С. 103-106.
51. Лусс Л.В. Выбор антигистаминных препаратов в лечении аллергических и псевдоаллергических реакций // Астма и аллергия. 2010. № 1-2. С. 70-76.
52. Инструкция по медицинскому применению лекарственного препарата Фенкарол® РУ № ЛП-002704 от 10.11.2014 с изменениями от 11.11.2019.
Рост распространенности атопического дерматита среди детей формирует глобальную медико-социальную проблему. Заболевание может протекать с разной клинической картиной, однако обязательным для всех пациентов симптомом является зуд, оказывающий значительное влияние на качество жизни пациента и его семьи.
В данной статье рассматриваются наиболее сильные пруритогены (гистамин, серотонин, интерлейкин-31 и т. д.), клинические проявления зуда при атопическом дерматите, а также основные принципы терапии данного симптома.

Зарегистрируйтесь, чтобы получить полный доступ к материалам
Зарегистрируйтесь на портале и получайте доступ к закрытому уникальному контенту*. Вы будете в курсе последних тенденций в области медицины и медицинского права при минимальных затратах Вашего времени.
* Доступно только специалистам здравоохранения.
другие статьи этой академии:
Дерматологическое бинго
Коллеги, мы нашли новый, не менее интересный способ поделиться с вами последними данными дерматологии,и обсудить вопросы диагностики и терапии такой распространенной проблемы, как зудящие дерматозы. Присоединяйтесь!
К полному тексту статьи >>Пищевая аллергия
Время прочтения: 15 мин.
Пищевая аллергия представляет собой повышенную чувствительность организма к пищевым продуктам и развитие признаков непереносимости пищи, вызванных реакцией иммунной системы.
К полному тексту статьи >>Влияние домашней пыли на развитие атопического дерматита. Профилактические мероприятия.
Время прочтения: 10 мин.
Очевидный факт, что бытовая пыль является постоянным спутником человеческой жизни. Даже в наглухо закрытом, непроветриваемом помещении в течение всего двух […]
К полному тексту статьи >>