Aнтиаритмические препараты I класса: теория и практика выбора
Алексей Владимирович Тарасов,
д.м.н., заведующий отделением хирургического лечения сложных нарушений ритма сердца и кардиостимуляции ФГБУ «Национальный медицинский исследовательский центр терапии и профилактической медицины» Минздрава России
За последнее время в решении проблемы нарушений ритма и проводимости сердца произошли достаточно серьезные изменения, появилось много нового. Сегодня сделаем акцент на антиаритмической терапии, в частности рассмотрим антиаритмические препараты (ААП) I C класса, поскольку именно в этом вопросе есть множество спорных, активно обсуждаемых моментов.
Все большую популярность приобретают всевозможные инвазивные методы лечения фибрилляции предсердий и желудочковых нарушений ритма. Однако мы все понимаем, что без медикаментозной стратегии как до катетерных методов лечения, так и после, все равно не обойтись. И, как объявлено на российском конгрессе аритмологов, который прошел в мае 2021 г. в Санкт-Петербурге, чтобы помочь нашим пациентам, мы должны работать и как хирурги, и как терапевты. Будучи врачом-терапевтом, специалистом в области аритмологии, я возглавляю отделение хирургического лечения сложных нарушений ритма, поэтому прекрасно понимаю, о чем идет речь.
Итак, об изменениях.
В 2020 г. опубликованы российские рекомендации по ведению пациентов с фибрилляцией и трепетанием предсердий (ТП), которые были утверждены Минздравом России1. В этом же году основательно пересмотрены европейские рекомендации по диагностике и лечению фибрилляции предсердий и антиаритмической терапии. Ранее, в 2018 г. представлен первый консенсусный документ, касающийся использования антиаритмических препаратов: Новые клинические рекомендации (консенсус) EHRA и ESC2018 г. по использованию антиаритмических средств2. Документ предложен и одобрен рядом кардиологических и аритмологических обществ Европы и Азии – Европейской ассоциацией сердечного ритма (European Heart Rhythm Association, EHRA), Европейским обществом кардиологов (European Society of Cardiology, ESC), Обществом сердечного ритма (Heart Rhythm Society, HRS). Российские клинические рекомендации насыщены текстовой информацией и таблицами, Новые клинические рекомендации (консенсус) EHRA и ESC2018 по использованию антиаритмических средств – большим количеством таблиц и алгоритмов, оба варианта удобны и полезны в клинической практике.
Антиаритмические препараты I c класса в лечении фибрилляции предсердий
В антиаритмической терапии больных с фибрилляцией предсердий (ФП) изменились ключевые позиции. Современная стратегия лечения пациентов с ФП заключается в профилактике тромбоэмболических осложнений путем антикоагулянтной терапии, в смягчении проявлений коморбидной патологии (сердечно-сосудистых заболеваний, ССЗ), в контроле частоты сердечных сокращений (ЧСС) и ритма сердца (рис. 1).
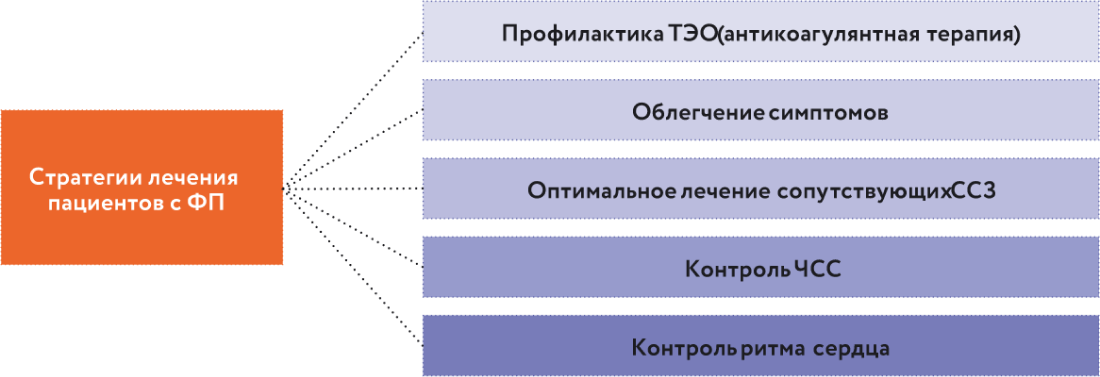
Рис. 1. Стратегия лечения пациентов с ФП.ФП – фибрилляция предсердий; ЧСС – частота сердечных сокращений; ТЭО – тромбоэмболические осложнения, CCЗ – сердечно-сосудистые заболевания.
Клинические рекомендации «Диагностика и лечение фибрилляции предсердий» Всероссийского Научного Общества специалистов по клинической электрофизиологии, Аритмологии и электрокардиостимуляции (ВНОА) в сотрудничестве с Российским Кардиологическим обществом (РКО) и Ассоциацией сердечно-сосудистых хирургов России (АССХ). 2017 годДля того, чтобы правильно выбрать стратегию ведения конкретного больного (контроль ЧСС или контроль ритма?), врач должен решитьтри основные задачи:
- Профилактика тромбоэмболических осложнений. Какой бы ни был перед вами пациент – первый раз вы его видите или давно курируете, какая бы форма ФП ни была – прежде всего нужно решить, необходима антикоагулянтная терапия или нет.
- Влияние на симптоматику и профилактику жизнеугрожающих аритмий (именно это изменилось в аритмологической практике и озвучено на российском конгрессе аритмологов).
- Выявление первопричины заболевания и воздействие на нее, поскольку любое нарушение ритма или проводимости сердца – это исход какой-то проблемы, и необязательно сердечной. Причиной может быть, к примеру, патология щитовидной железы, которая привела к гипертиреозу, а он, в свою очередь, к непрерывной, рецидивирующей фибрилляции предсердий.
ВАЖНО! Аритмия всегда вторична.
Для пациентов с ФП неотъемлемой частью лечения является восстановление и поддержание синусового ритма.
Как было раньше? Если врач выявлял ФП у пациента бессимптомно, то надо было срочно вызвать на себя бригаду «скорой помощи», срочно пациента госпитализировать. Сейчас в наших российских рекомендациях четко прописаны действия врача. Если клиническое течение асимптомное, ФП не влияет на гемодинамику, не страдает функция сердца, и пациент не жалуется на снижение толерантности к физической нагрузке, либо эта аритмия не усугубляет другие ситуации, то в общем-то можно не спешить, а очень внимательно взвесить, надо ли восстанавливать этот ритм или не надо? И, если пациент молодой, то, конечно, выбираем восстановление ритма. Если пациент старше 60 лет, то чаще на первый план выходят обеспечение нормосистолии и контроль ЧСС.
Стратегия контроля ритма показана пациентам с ФП, у которых на фоне адекватного медикаментозного контроля ЧСС сохраняются клинические симптомы.
Пациентам с персистирующей или длительно-персистирующей формой ФП рекомендуется кардиоверсия ФП (электрическая или фармакологическая) как часть ритм-контроль терапии.
За исключением ФП, связанной с нестабильной гемодинамикой, при выборе между электрической и фармакологической кардиоверсией следует руководствоваться предпочтениями пациента и врача.
Фармакологическая кардиоверсия фибрилляции предсердий
Алгоритм осуществления фармакологической кардиоверсии ФП представлен на рис. 2.
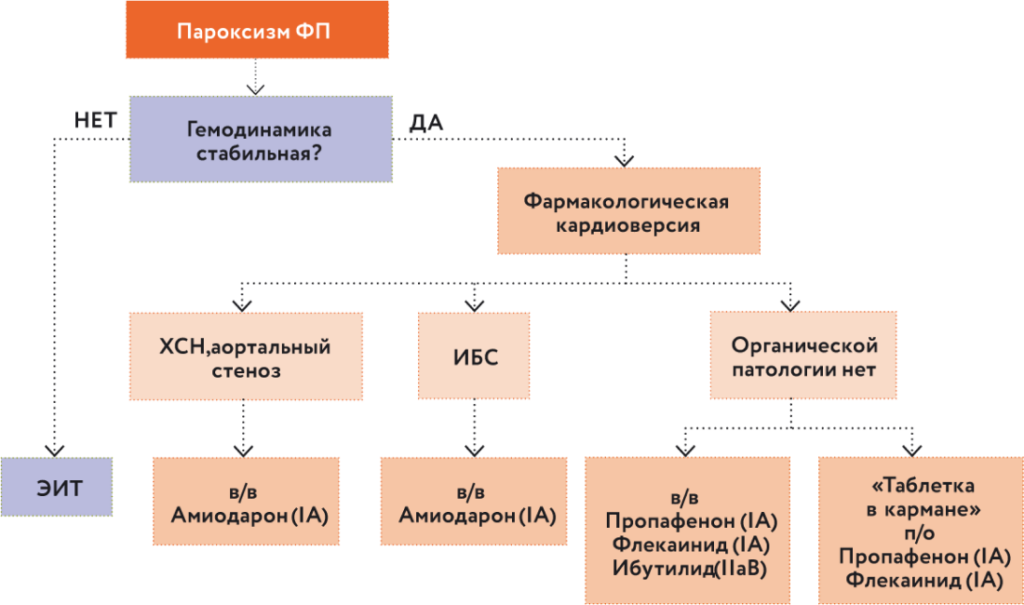
Рис. 2. Алгоритм осуществления фармакологической кардиоверсии ФП.Диагностика и лечение фибрилляции предсердий Клинические рекомендации РКО, ВНОА и АССХ, 2017
2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS.Выбор препаратов для реализации фармакологической кардиоверсии ФП зависит от наличия или отсутствия у пациента органической патологии. Антиаритмические препараты I С класса (пропафенон, флекаинид, ибутилид) мы чаще всего выбираем в отсутствие органической патологии.
Если есть органическая патология сердца – для восстановления ритма применяем лекарственный препарат III класса амиодарон. Следует отметить, что в российских клинических рекомендациях 2020 г.1 действия врача конкретизированы (рис. 3).
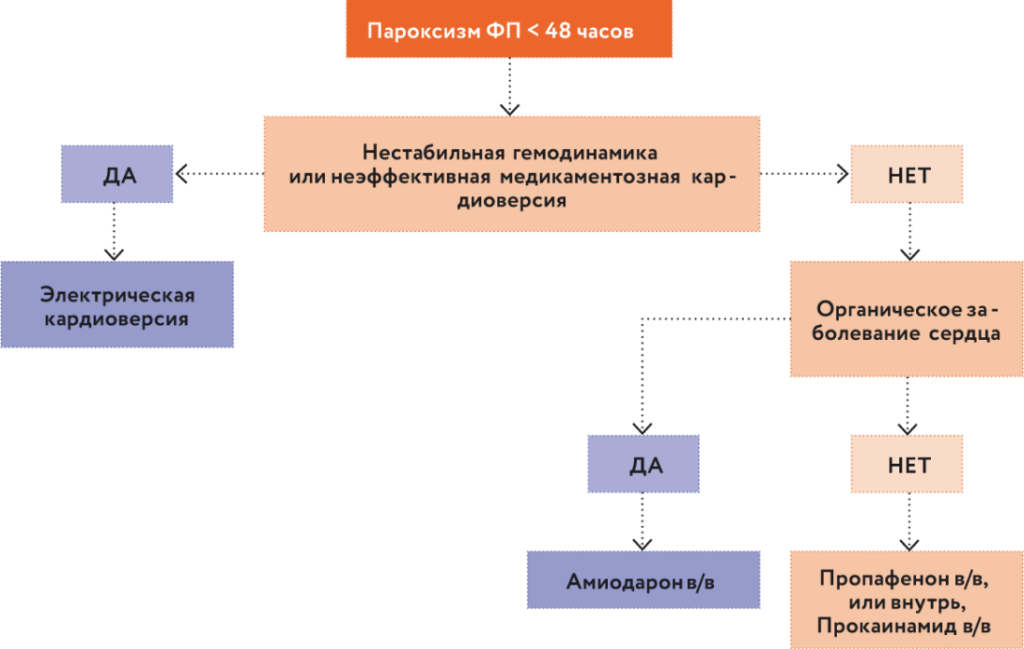
Рис. 3. Купирование пароксизма ФП, длящегося менее 48 часов.Если раньше мы лечили пациентов в целом с мерцательной аритмией, то теперь разделены подходы к лечению пациентов с пароксизмальной формой и персистирующей формой мерцательной аритмии. Абсолютная эффективность антиаритмиков отличается в корне. Если перед нами пациент с типичным пароксизмом продолжительностью до 48 часов, лечение остается прежним: нет органической патологии сердца – назначаем препараты I C класса (пропафенон либо прокаинамид). Есть органическая патология сердца – назначаем препарат III класса амиодарон, предполагаемая эффективность восстановления ритма 80%. Если же пациент с персистирующей формой ФП, и фибрилляция длится более 7 суток, то в этой клинической ситуации амиодарон теряет свою эффективность (максимум 20–40%) (рис. 4). К тому же напомню, что ежегодно появляются новые данные о токсичности амиодарона, в связи с чем были предприняты меры предосторожности со стороны FDA и Центра экспертизы безопасности лекарственных средств России.
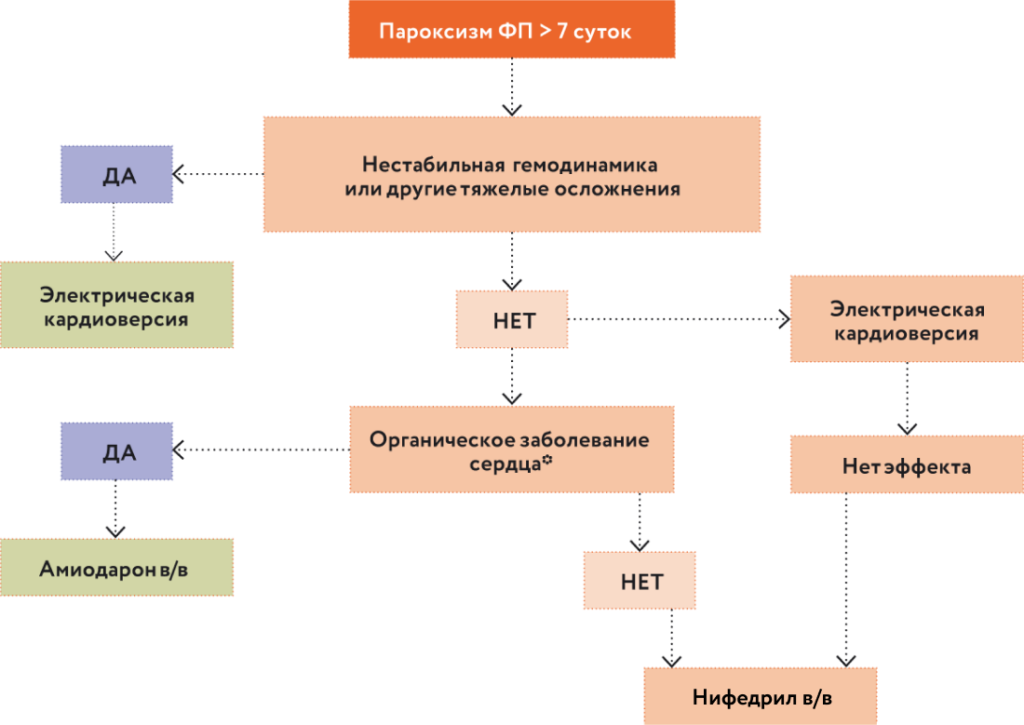
Рис. 4. Купирование пароксизма ФП, длящегося 7 суток и более.В этой клинической ситуации рекомендован российский препарат ниферидил (4-нитро-N-[(1RS)-1-(4-фторфенил)-2-(1-этилпиперидин‑4-ил)этил]бензамида гидрохлорид, торговое название РЕФРАЛОН®), предназначенный для лечения именно персистирующих форм и длительно персистирующих форм, повторяю, если нет органической патологии сердца.
Для лечения пациентов с персистирующей формой чаще используем электрическую кардиоверсию, поскольку доказано что электрическая кардиоверсия (электроимпульсная терапия) – высокоэффективный метод, позволяющий быстро восстановить синусовый ритм. Однако после восстановления ритма могут отмечаться рецидивы ФП.
Профилактика повторения ФП
Изложенные в российских и европейских клинических рекомендациях, а также в консенсусном документе по использованию антиаритмических препаратов подходы к профилактике повторения ФП в целом совпадают.
Принципы фармакологического восстановления и поддержания сердечного ритма при гемодинамически стабильном состоянии после ФП представлены на рис. 53.
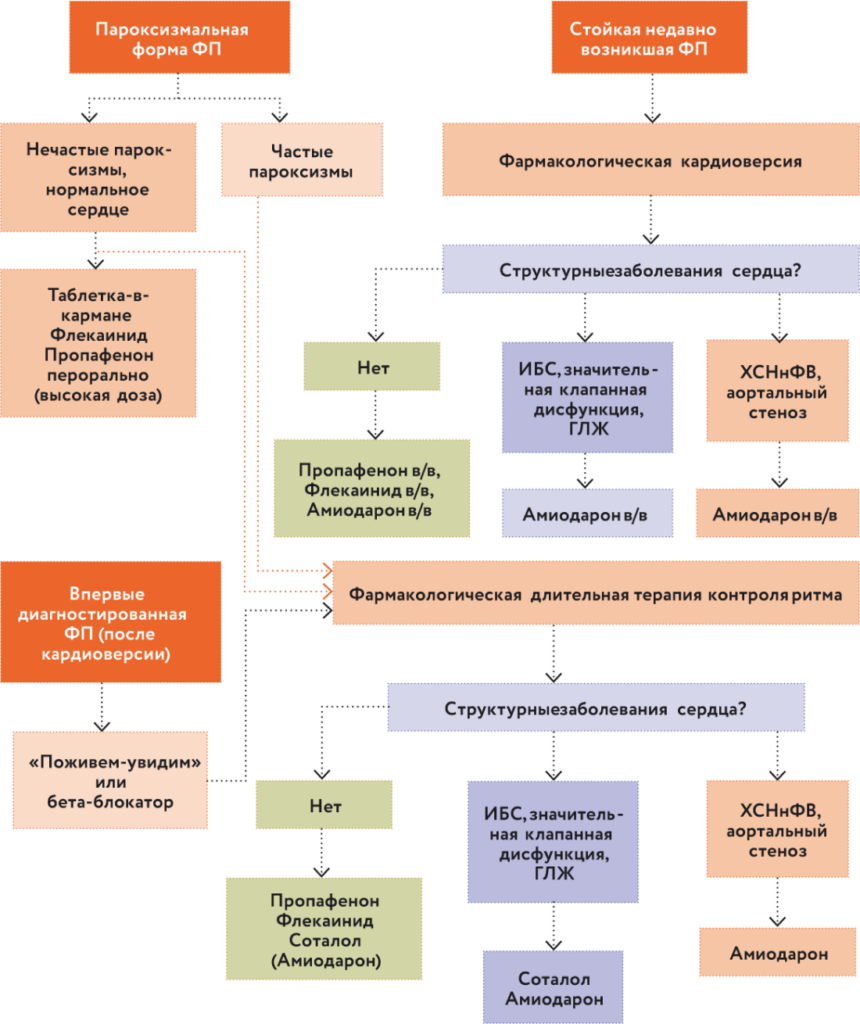
Рис. 5. Фармакологическое восстановление и поддержание сердечного ритма при гемодинамически стабильном состоянии после ФП.Выбор способа профилактики зависит от частоты пароксизмов. Редкими принято считать пароксизмы, повторяющиеся менее трех раз в течение года. Если ваш пациент говорит, что у него 1–3 приступа мерцательной аритмии в год, нужно научить пациента купировать эти приступы, стараясь не допускать действие факторов, которые провоцируют аритмию. Но ААП не назначать.
Пациентам с редкими пароксизмами ФП, не принимающим поддерживающую антиаритмическую терапию, без сопутствующего структурного заболевания сердца или ишемической болезни сердца (ИБС), при условии продолжительности аритмии менее 48 часов для восстановления синусового ритма может быть рекомендован однократный самостоятельный пероральный прием пропафенона или флекаинида по принципу «таблетка в кармане».
Если приступы повторяются более трех раз в год, если приступы тяжелые либо выраженно влияют на гемодинамику, то следует применять инъекционные препараты.
ВАЖНО! Нельзя после применения амиодарона купировать пароксизм ФП препаратом I C класса. Почему? Потому что амиодарон имеет медленный шлейф выведения, вследствие чего возможна реакция, связанная с межлекарственным взаимодействием.
И, конечно же, следует назначать препараты для «противорецидивной» терапии, то есть после купирования пароксизма ФП продолжать прием антиаритмика уже в таблетированной форме.
Поскольку произошли некоторые изменения в дозировании и применении препаратов пропафенон и амиодарон, остановимся на особенностях их использования (табл. 1).
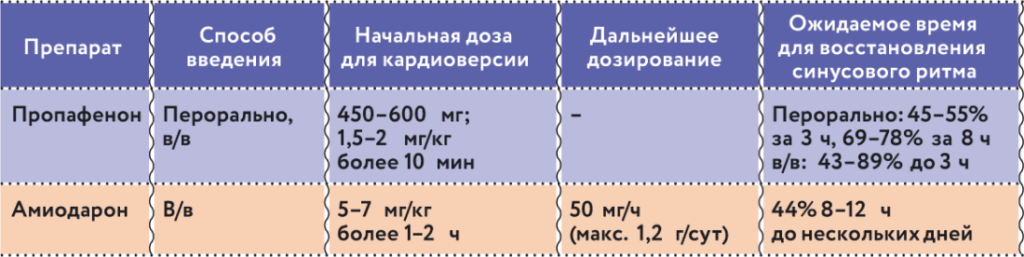
Таблица 1. Применение препаратов пропафенон и амиодаронПримечание. Пропафенон противопоказан при ИБС, ХСН, ФВ ЛЖ <40%, гипертрофии ЛЖ >1,4 см. Соблюдать осторожность при нарушении СА- и АВ-проводимости, при почечной и печеночной недостаточности, бронхиальной астме. Может индуцировать АГ, ТП с проводимостью 1:1 (у 3,5—5,0% пациентов), умеренное расширение QRS. Амиодарон может вызвать флебит, артериальную гипотензию, брадикардию/атриовентрикулярную блокаду.
Изменения коснулись преимущественно амиодарона. Мы используем схему применения болюсов: сначала вводим 300 мг болюсно, и потом уже либо докапываем, либо 1000–1200 мг внутрь. Почему? Потому что препарат амиодарон не на игле восстанавливает ритм, он медленно работает, среднее время восстановления ритма – 8–12 часов. Наши европейские коллеги вместо привычной для нас схемы применения болюсов предлагают вводить этот препарат по 5–7 мг/кг тела внутривенно капельно в растворе глюкозы в течение часа. Эффективность, что болюсно, что капельно, абсолютно одинакова. Преимущество нашей методики обусловлено тем, что при введении болюса сначала включается бета-блокирующий эффект амиодарона, и ритм несколько урежается. Это дает возможность стабилизировать или улучшить гемодинамику. И все же выбор способа введения зависит от индивидуальной клинической картины у пациента.
При выявлении ФП всегда врач оказывается перед выбором: назначать ли антиаритмический препарат? Если назначать, то какой? Как долго должен пациент принимать препарат, и какие мы можем ожидать побочные эффекты? Будет ли эффективен и безопасен этот препарат в конкретных условиях, при определенной коморбидной составляющей данного пациента (рис. 6).
Рис. 6. Стратегия выбора метода лечения пациентов с ФП.Для контроля ритма при ФП в настоящее время мы используем только 5 антиаритмических препаратов: это представители I C класса пропафенон 300–600 мг/сут, Этацизин 100–150 мг/сут., лаппаконитина гидробромид (Аллапинин®) 75–100 мг/сут. и III класса – соталол 80–160 мг/сут., амиодарон 200–600 мг/сут. и сочетание этих препаратов с β-адреноблокаторами 50–100 мг/сут., верапамилом 80–240 мг/сут.
β-адреноблокатор как представитель II класса ААП или верапамил как представитель IV класса ААП – это всетаки препараты, которые, в основном, направлены на реализацию стратегии контроля ЧСС.
Выбор препарата для антиаритмической терапии зависит от наличия или отсутствия органической патологии сердца. На рис. 7 представлен алгоритм реализации стратегии «ритм-контроль», предложенный как в российских, так и европейских рекомендациях и проверенный нами на практике1–3.
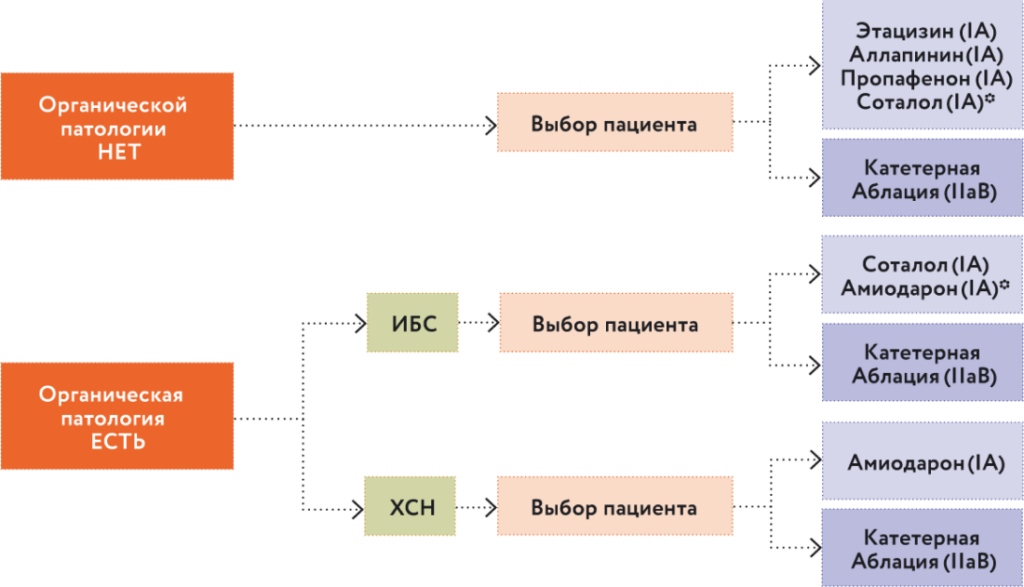
Рис. 7. Алгоритм реализации стратегии «ритм-контроль». * Амиодарон должен быть последним препаратом выбора в связи с высоким риском экстракардиальных осложнений
Диагностика и лечение фибрилляции предсердий Клинические Рекомендации МЗ РФ от 2020
В любом случае принятию решения о выборе препарата должна предшествовать беседа с пациентом.
Если ваш пациент говорит, что у него приступы ФП вечерние, ночные, ранние утренние, то здесь, скорее всего, преобладает ваготонический механизм, и в данном случае необходим препарат I C. Если ваш пациент говорит, что у него пароксизм ФП возникает при физической нагрузке, при повышении уровня артериального давления, при стрессе, это означает, что в данном случае преобладает другой механизм, катехоламиновый, и будет уместен β-адреноблокатор или соталол.
ВАЖНО! Амиодарон не назначают пациентам без органической патологии сердца. В противном случае мы должны четко обосновать, почему пациенту без органической патологии сердца назначен достаточно жесткий органотоксичный препарат амиодарон.
Мне нравится, как наши европейские коллеги говорят: «Чтобы назначить амиодарон пациенту без органической патологии сердца, я пишу на двух страницах разъяснение и четкое обоснование». Это принципиально важно, мы должны помнить, амиодарон – это препарат, который в течение года у каждого второго пациента вызовет всевозможные побочные эффекты.
Далее пациенту без органической патологии сердца мы можем предложить катетерные методы лечения.
Если у пациента есть органическая патология сердца, ему показаны либо амиодарон, либо соталол. Но обращаю ваше внимание – соталол можно применять для профилактики рецидивов ФП у больных после инфаркта миокарда при условии, что у пациента сохранена фракция выброса левого желудочка (ФВ ЛЖ). Если ФВ ЛЖ низкая, то назначают только амиодарон и даже в сочетании с β-адреноблокатором в небольшой дозе. Почему? Потому что амиодарон не защищает от внезапной смерти, он уменьшает риск развития ФП и желудочковых нарушений ритма, а β-адреноблокатор дает некую протекцию в плане внезапной сердечной смерти у пациентов с сердечной недостаточностью. И возникает вопрос: а что же такое органическая патология сердца? На чем базируется это разделение: кому – «да», кому – «нет». Для данного контекста, безусловно, принципиальна следующая позиция4,5.
Органические изменения сердца, которые следует учитывать при назначении антиаритмических препаратов:
- выраженные признаки сердечной недостаточности (СН);
- ФВ ЛЖ менее 40%;
- острые формы ИБС или перенесенный инфаркт миокарда;
- гипертрофия левого желудочка (ГЛЖ) более 1,4 см.
Не являются противопоказанием к назначению ААП I C класса:
- артериальная гипертензия;
- хронические формы ИБС без инфаркта (в сочетании с β-адреноблокатором);
- невыраженные пороки сердца.
Противопоказания к назначению ААП I C класса:
- острые формы ИБС или перенесенный инфаркт миокарда, наличие рубца и фиброзных изменений левого желудочка (не является противопоказанием состояние после успешной реваскуляризации стеноза (стенозов) коронарных артерий);
- сердечная недостаточность с ФВ ЛЖ менее 40%;
- гипертрофия межжелудочковой перегородки.
Последнее утверждение вызвало дискуссию, что нашло отражение даже в перечисленных выше рекомендательных документах. Почему? Потому что нет результатов рандомизированных исследований у такой категории пациентов (не говоря о больных с гипертрофической кардиомиопатией), хотя ФП часто возникает именно у пациентов с гипертрофией ЛЖ.
Чем обусловлены противопоказания ААП I C класса пациентам с органической патологией сердца? Эти препараты могут вызывать неприятный и опасный проаритмический эффект, обусловленный механизмом повторного входа волны возбуждения (re-entry) (рис. 8, 9). И вот самый простой пример.
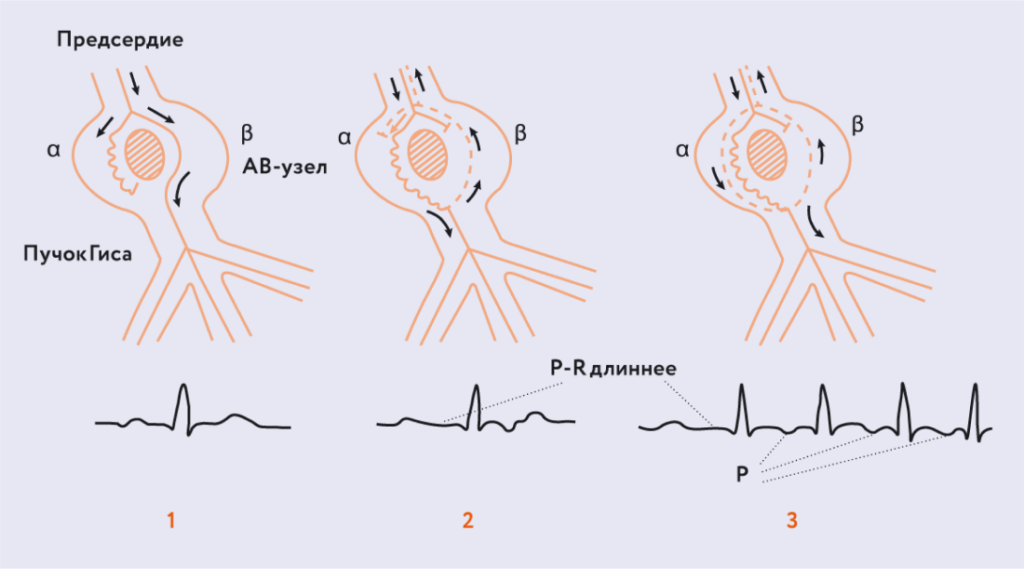
Рис. 8. Проаритмические эффекты ААП I C класса: усугубление реципрокных аритмий [Douglas P. Zipes 2008]. 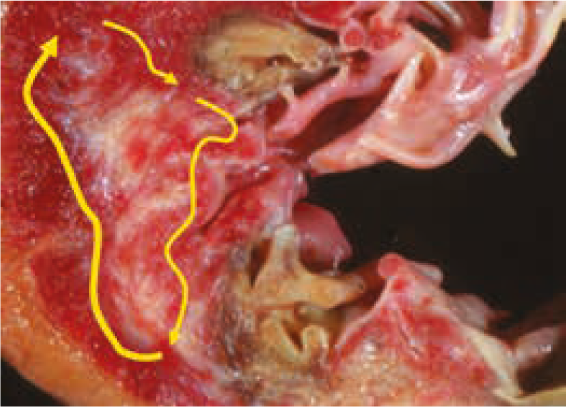
Рис. 9. Re-entry у пациента с рубцовым поражением миокарда (схема).Обратился к вам больной с ФП, вы назначили ААП I C класса. И пациент к вам возвращается уже с трансформацией из ФП в ТП. Этот эффект возникает почти у 7% лиц вследствие приема ААП I C класса. Произошла трансформация в макро re-entry, в лучшем случае, если на уровне предсердий. А если у вашего пациента есть условия для re-entry на уровне миокарда желудочков, то возможно развитие обусловленной re-entry желудочковой тахикардии.
ААП I класса, способные индуцировать reentry тахикардию:
- ААП I A класса – хинидин, прокаинамид (Новокаинамид);
- ААП I C класса – Аллапинин®, Этацизин, пропафенон.
Проаритмические эффекты могут также вызывать ААП III класса амиодарон и соталол, хотя и реже.
У пациентов с ФП часто (от 30 до 50%) встречается сопутствующая патология – хроническая болезнь почек (ХБП). Выявлено двунаправленное взаимодействие между ФП и ХБП: ХБП предрасполагает к развитию ФП, а наличие ФП сопряжено с ухудшением внутрипочечной гемодинамики, риском дальнейшего снижения скорости клубочковой фильтрации (СКФ) и нарастания альбуминурии.
Примерно у одного из пяти пациентов с ХБП имеется впервые диагностированная ФП, а у 50% пациентов с ФП имеются разной степени выраженности нарушения фильтрационной функции почек. По сравнению с пациентами только с наличием ФП или ХБП, у пациентов с их сочетанием имеется повышенный риск инсульта и смерти из-за чрезмерного риска развития тромбоэмболических осложнений. Это усложняет стратификацию риска и лечение.
Пациентам с ФП при назначении ААП рекомендована коррекция дозы препарата исходя из уровня СКФ с учетом потенциального удлинения времени полувыведения вещества (табл. 2).
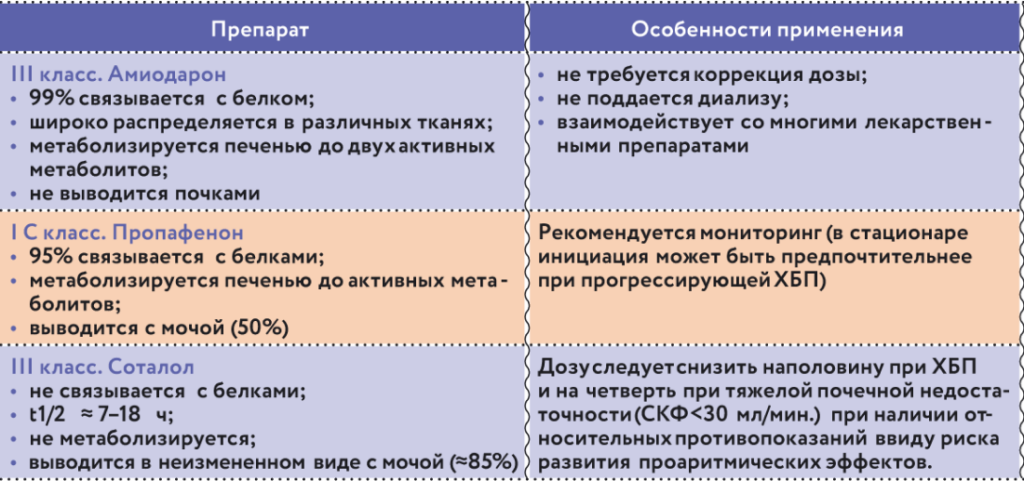
Таблица 2. Антиаритмические препараты при ХБПСложности, связанные с выбором ААП, желание получить максимальный эффект и минимальное количество осложнений приводят нас к закономерному вопросу: каким должен быть идеальный ААП?
Идеальный антиаритмический препарат: какой он?
Безопасный – идеальный антиаритмик должен быть малотоксичным и обладать малой вероятностью развития тяжелых побочных реакций.
Эффективный и универсальный – идеальный антиаритмик должен обладать универсальным противоаритмическим действием, т. е. высокой активностью как при наджелудочковых, так и при желудочковых нарушениях ритма.
Доступный и удобный – должны быть предусмотрены формы для приема внутрь (per os), удобные для амбулаторного лечения аритмии.
Иными словами, когда мы назначаем какой-либо антиаритмический препарат, особенно I C класса, мы хотим быть уверенными, что это безопасно, эффективно и удобно в использовании (табл. 3, рис. 10).
ВАЖНО! Как бы мы хорошо не относились к препаратам I C класса, мы не назначаем их больным с инфарктом миокарда, сердечной недостаточностью и ФВ ЛЖ ниже 40%, с блокадами ножек пучка Гиса6.
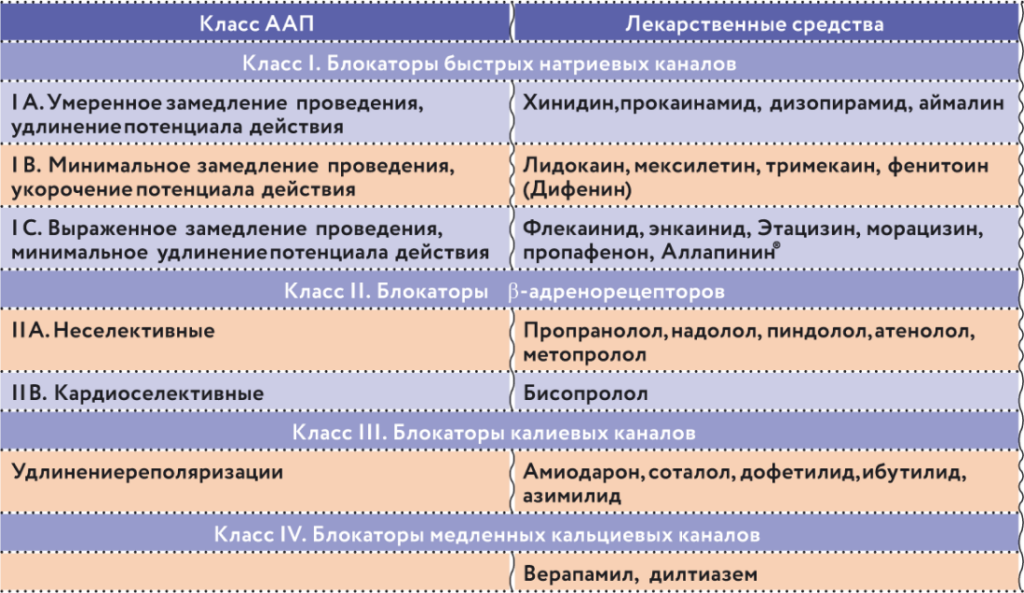
Таблица 3. Классификация ААП по Вогану Вильямсу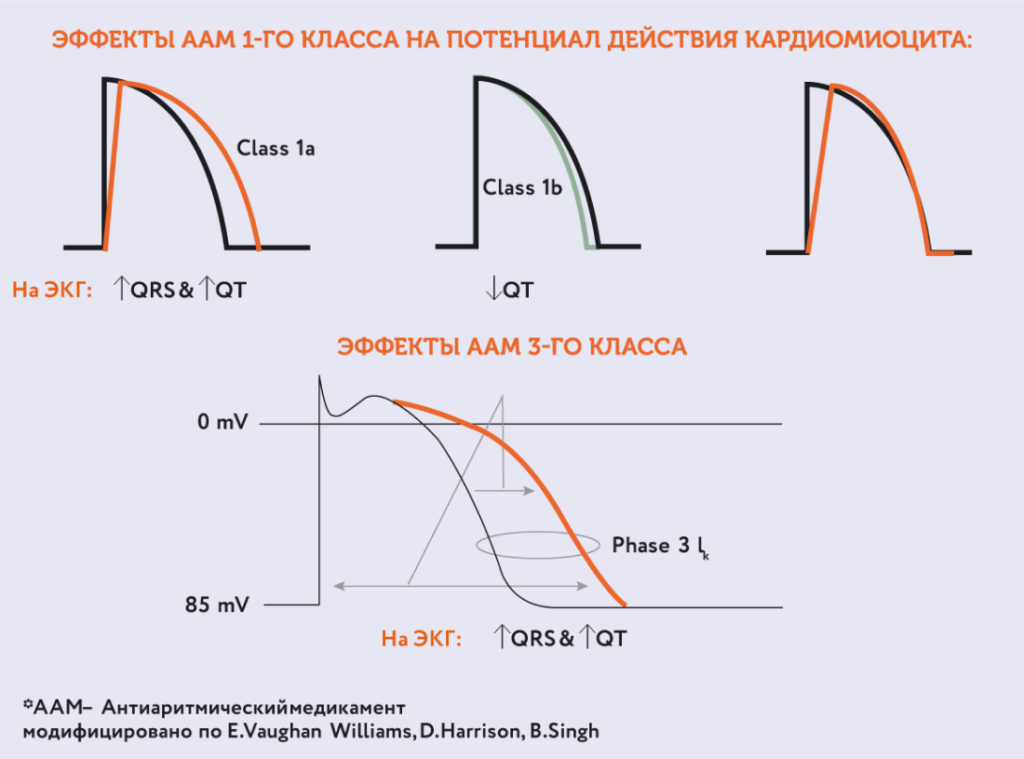
Рис. 10. Эффекты, вызываемые ААП I и III классов.ААП – представители I C класса – это препараты, которые блокируют быстрые натриевые каналы. Это их общее свойство.
Чем они между собой различаются? Различаются эти препараты влиянием на β-адреноблокаторы.
Пропафенон оказывает блокирующее действие на β-блокаторы, поэтому мы пропафенон никогда не назначим пациенту с бронхиальной астмой, потому что это может усугубить течение заболевания. Замедляет деполяризацию в клетках миокарда. Применяется для профилактики ФП у пациентов без структурного заболевания сердца. Его не следует назначать пациентам с ИБС или сниженной ФВ ЛЖ. Необходимо соблюдать осторожность при его назначении больным с нарушением внутрижелудочковой проводимости, особенно с блокадой левой ножки пучка Гиса. Назначение пропафенона должно сопровождаться контролем длительности комплекса QRS на ЭКГ. Увеличение длительности комплекса QRS по крайней мере на 25% по сравнению с исходным указывает на риск развития проаритмического действия. В таких случаях следует снизить дозу или отменить препарат. Пропафенон способен вызывать трансформацию ФП в ТП.
Аллапинин® (действующее вещество лаппаконитина гидробромид) –может быть использован для лечения пациентов без структурного заболевания сердца и пациентов с АГ без выраженной (≤14 мм) гипертрофии миокарда ЛЖ. Нельзя назначать при ИБС, клинически значимой ХСН, АГ с выраженной гипертрофией ЛЖ (>14 мм) в связи с риском проаритмического действия. Угнетает атриовентрикулярное и внутрижелудочковое проведение возбуждения, поэтому требуется контроль длительности интервала PQ и комплекса QRS. Как и другие ААП I C класса, способен вызвать трансформацию ФП в ТП. Наиболее частые побочные действия – головокружение, головная боль, нарушение фиксации взора. Аллапинин® опосредованно работает как β-адреностимулятор, и нам приходится добавлять какой-либо бета-блокатор либо даже соталол с учетом его β-адреноблокирующего действия.
Особый интерес в этой группе препаратов представляет Этацизин (действующее вещество диэтиламинопропионил-этоксикарбонил-аминофенотиазин), поскольку он не только блокирует быстрые натриевые каналы, но и вызывает мягкий эффект блокады медленных кальциевых каналов. Применяется для сохранения синусового ритма при пароксизмальной ФП и персистирующей ФП после кардиоверсии. Может быть использован для лечения пациентов без органического заболевания сердца и у пациентов с АГ без гипертрофии ЛЖ (толщина миокарда ЛЖ менее 15 мм по данным ЭхоКГ).
Механизм действия Этацизина
- ↓ автоматизм, проведение;
- ↑ порог возбуждения (блокада Na+ каналов);
- антиишемический эффект (блокада Ca2+ каналов);
- ↓ эффект n.vagus на сердце (холиноблокада);
- стабилизация вегетативной нервной системы (производное фенотиазина) (рис. 11).
ВАЖНО! Назначая этот препарат, необходимо контролировать длительность комплекса QRS и интервала PQ на ЭКГ. Увеличение длительности QRS на 25% и более – сигнал к уменьшению дозы или к отмене препарата. Кроме того, препарат не влияет на ЧСС.

Рис. 11. Механизм действия Этацизина.Влияние Этацизина на ЭКГ представлено на рис. 12.
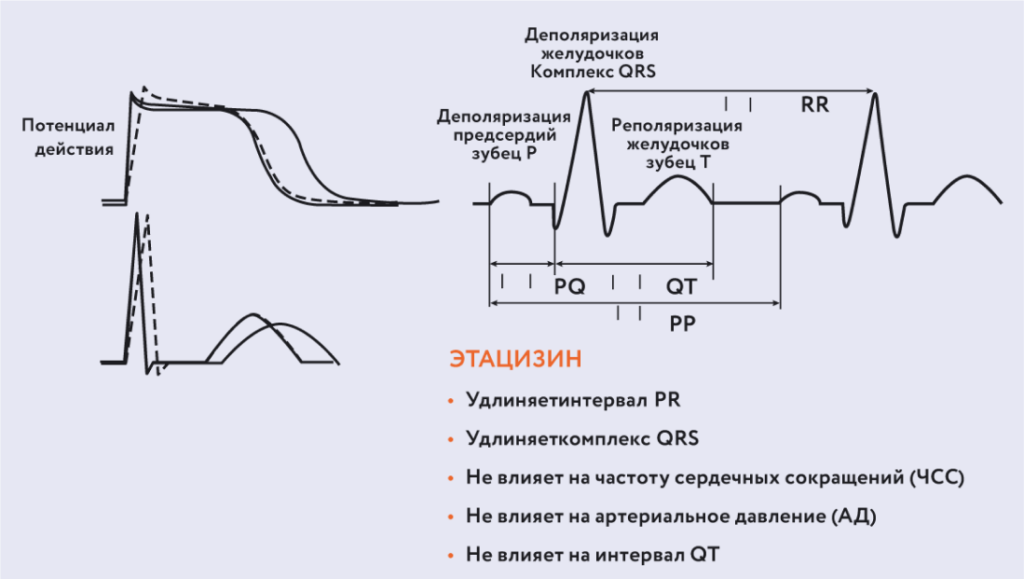
Рис. 12. Влияние Этацизина на ЭКГ.Клиническая фармакология антиаритмических средств http://vmede.org/sait/?page=5&id=farmakologija_klin_farm_lect_2009&menu=farmakologija_klin_farm_lect_2009 инструкция по применению этацизинПротивопоказания к назначению: ИБС, ХСН, АГ с гипертрофией ЛЖ в связи с риском проаритмического действия.
Редкие побочные эффекты: головокружение, головная боль, расстройства зрения.
Фармакокинетика Этацизина представлена на рис. 137.
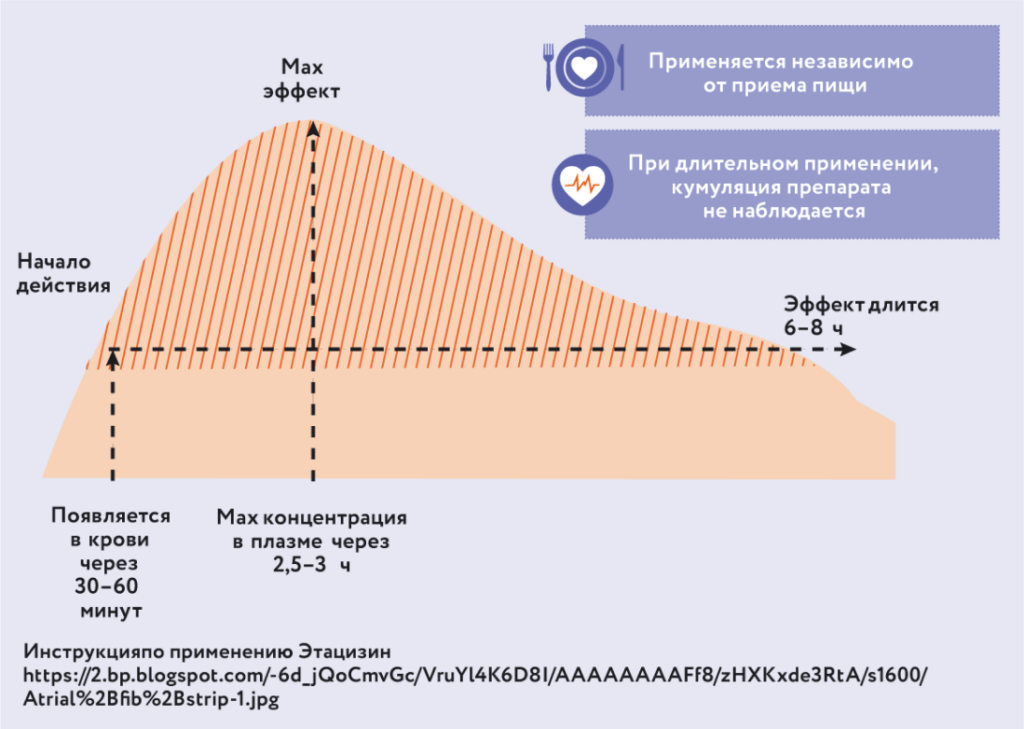
Рис. 13. Фармакокинетика ЭтацизинаКлинические события, в которых Этацизин является препаратом первого выбора:
- как стратегия ритм-контроль у больных с ФП без органической патологии с симптомной аритмией, особенно у больных с АГ, при повышенном вагусном тонусе;
- как стратегия ритм-контроль у больных с сочетанием ФП, предсердных тахиаритмий и ТП, то есть с аритмиями макро re-entry;
- как вариант лечения симптомной предсердной и желудочковой экстрасистолии в отсутствие органической патологии сердца.
Вспоминаем о важности беседы с пациентом.
Во-первых, если пациент рассказывает: время возникновения пароксизмов – вечер, ночь, утро, после еды, – это означает преобладание ваготонического механизма, мы имеем дело с так называемой ваготонической ФП, значит в данном случае можно назначать препарат Этацизин.
Во-вторых, нередко к нам приходят пациенты, у которых есть и ФП, и ТП, и другие предсердные регулярно возникающие тахиаритмии. Именно в данном случае умеренный эффект антагонистов кальция, блокады кальциевых каналов, присущий Этацизину, нам помогает при re-entry. На фоне приема данного препарата гораздо реже возникают re-entry тахикардии или ТП. Иногда нам приходится к Этацизину добавлять верапамил, чтобы усилить этот эффект, но именно для пациентов, у которых ярко выражена склонность к re-entry и другим вариантам предсердных тахикардий. Безусловно, мы титруем эти дозы и тщательно наблюдаем за состоянием пациента.
Антиаритмические препараты I c класса в лечении желудочковой экстрасистолии
Желудочковая экстрасистолия (ЖЭС) – это преждевременное возбуждение сердца, возникающее под влиянием импульсов, исходящих из различных участков проводящей системы желудочков. Источником ЖЭС в большинстве случаев являются разветвления пучка Гиса и волокна Пуркинье. ЖЭС – одна из самых распространенных желудочковых аритмий. Патология может быть связана с органическим заболеванием сердца или носить функциональный характер.
Классификация ЖЭС
По локализации очага:
- левожелудочковая экстрасистолия;
- правожелудочковая экстрасистолия.
По количеству очагов:
- монотопная (одинаковая морфология комплекса QRS и фиксированная величина интервала сцепления);
- политопная (разная морфология комплекса QRS и величина интервала сцепления).
По интервалу сцепления:
- ранняя (отношение интервалов сцепления ЖЭС к длительности интервала QT основного ритма ˂1);
- поздняя (отношение интервалов сцепления ЖЭС к длительности интервала QT основного ритма ˃1);
- ЖЭС типа зубец R наслаивается на зубец T (ЖЭС наслаивается на зубец Т предшествующего комплекса основного ритма).
По кратности индукции по отношению к основному ритму (аллоритмия):
- бигеминия;
- тригеминия;
- квадрогеминия;
- одиночная;
- куплет (парная);
- триплет (тройная);
- неустойчивая желудочковая тахикардия (4 и более ЖЭС и длительностью до 30 с.).
Лечение желудочковой экстрасистолии является сложной задачей; выбор тактики лечения зависит от причины ее возникновения и влияния ее на прогноз.
ЖЭС может возникать в виде аритмии структурно нормального сердца (идиопатическая) илипри наличии органической патологии сердца.
Терапия ЖЭС у больных без органической патологии сердца:
- Протекторная терапия (препараты калия, магния, метаболические препараты, витамины и т. д.).
- Седативная терапия.
- Антиаритмические препараты:
• II класс (β-адреблокаторы);
• I C класс (пропафенон, Этацизин, Аллапинин®);
• III класс (соталол). - Радиочастотная аблация (РЧА) эктопического очага.
ВАЖНО! Только при неэффективности перечисленных методов можно рассматривать назначение амиодарона или применение имплантации кардиовертера-дефибриллятора.
Как лечить молодых пациентов без органической патологии сердца? Мы не спешим с назначением антиаритмиков, если эта аритмия не вызывает снижение гемодинамики, назначаем так называемую протекторную терапию, седативную терапию. Но если есть необходимость в антиаритмиках, рекомендованы только две группы препаратов – это β-адреноблокаторы и препараты I С класса пропафенон, Этацизин и Аллапинин®. Возможность применения препарата соталол при желудочковых экстрасистолиях является предметом дискуссии.
Как вариант, возможна РЧА эктопического очага, в редких случаях используем амиодарон.
При органической патологии сердца мы должны воздействовать, прежде всего, на основное заболевание.
Терапия ЖЭС у больных с органической патологией сердца:
- Терапия основного заболевания.
- Протекторная терапия (препараты калия, магния).
- Антиаритмические препараты (β-адреноблокаторы или в сочетании с амиодароном).
- Реваскуляризация миокарда.
- Установка имплантируемого кардиовертера-дефибриллятора (ИКД).
- РЧА аритмогенного очага.
- Хирургическое лечение хронической аневризмы сердца.
Препараты I C класса применяют и в лечении ЖЭС, препаратом выбора является Этацизин, а при желудочковой эктопии некоронагенного генеза – препаратом первой линии.
Эффективность Этацизина оказалась очень высокой, до 90%, и сохранялась в течение 36 месяцев
Эффективность применения Этацизина при лечении пациентов с желудочковой парасистолией тщательно изучена в ФГБУ «Национальный медицинский исследовательский центр имени В. А. Алмазова» Минздрава России (Санкт-Петербург)8. Мало того, что эффективность оказалась очень высокой, до 90%, она сохранялась в течение 36 месяцев (рис. 14).
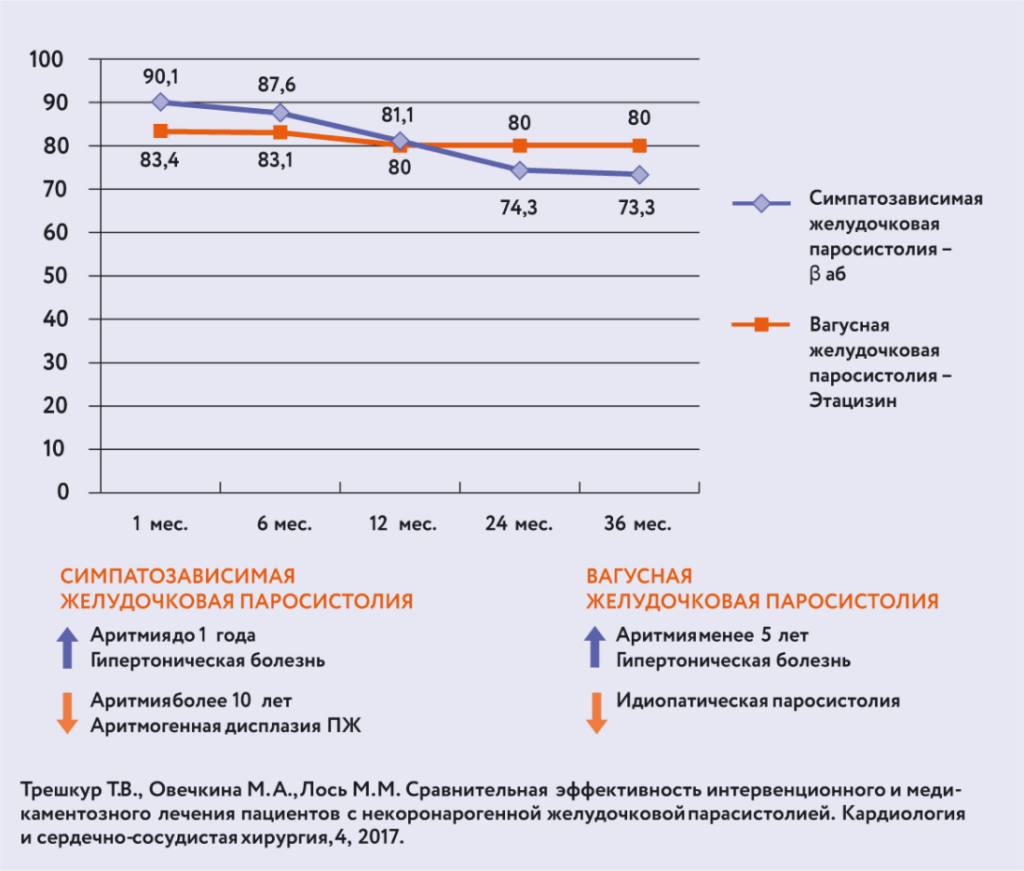
Рис. 14. Эффективность (%) медикаментозной терапии желудочковой парасистолии.Еще одно важное преимущество Этацизина заключается в том, что во многих случаях достаточно половинных доз для подавления эктопии. Но при ФП необходима только полноценная доза: 2–3 таблетки.
Эффективность терапии ЖЭС у больных с выраженной органической патологией сердца изучена в ходе крупных исследований EMIAT и CAMIAT9. Результаты представлены на рис. 15. В исследование включены больные с тяжелой степенью ИБС и ХСН. В группе плацебо летальность достигла 10%. Еще раз подтверждено, что амиодарон плохо влияет на профилактику внезапной смерти. Обратите внимание: прием β-адреноблокаторов способствовал почти двукратному снижению показателей смертности. Наиболее эффективным оказалось сочетание амиодарона и β-адреноблокаторов.
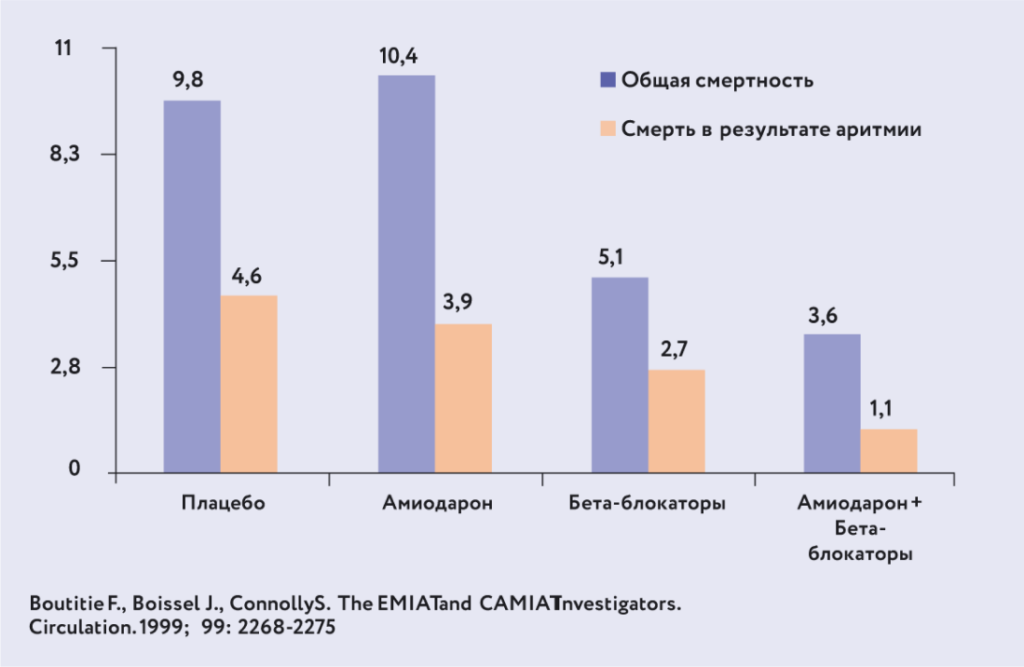
Рис. 15. Результаты исследований EMIAT и CAMIAT.Результаты еще одного варианта лечения ЖЭС представлены на рис. 16. В процессе обсуждения целесообразности применения препарата соталол большинство экспертов пришли к выводу, что он менее эффективен, чем β-адреноблокаторы, в отличие от лечения ФП, когда соталол предпочтительнее10.
В заключение считаю необходимым отметить, что выбирая тот или иной АПП, мы должны все таки помнить, что препараты этой группы не лечат, а лишь подавляют нарушение ритма.
Чтобы добиться успеха, следует соблюдать принципы терапии нарушений ритма с учетом эффективности и безопасности: лечить в первую очередь основное заболевание, определять эффективную стратегию лечения аритмии с учетом симптомов у конкретного пациента; оценивать безопасность выбранной стратегии; снижать вероятность межлекарственного взаимодействия.
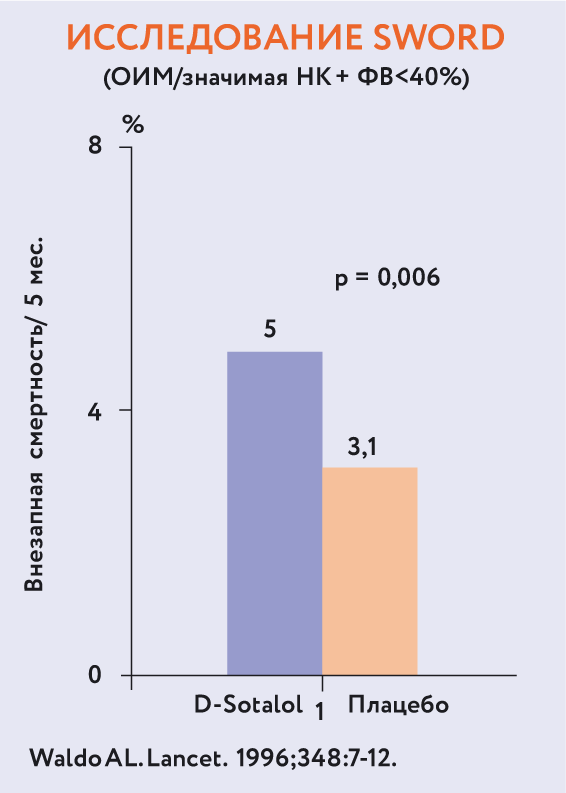
Рис. 16. Эффективность различных видов терапии желудочковой экстрасистолии.Выбор стратегии лечения аритмии при выявлении нарушений ритма сердца является непростой задачей для врача. Невзирая на развитие инвазивных методов лечения, медикаментозный подход является основой терапии фибрилляции предсердий и желудочковых нарушений ритма. Чтобы разобраться в тонкостях и нюансах фармакотерапии, мы предлагаем Вам прочитать статью Алексея Владимировича Тарасова, в которой он ответит на следующие вопросы:
- Какие ключевые цели антиаритмической терапии?
- Как предупредить рецидивы фибрилляции предсердий?
- Как выбрать наиболее безопасный и эффективный препарат в зависимости от наличия или отсутствия органической патологии сердца?

Зарегистрируйтесь, чтобы получить полный доступ к материалам
Зарегистрируйтесь на портале и получайте доступ к закрытому уникальному контенту*. Вы будете в курсе последних тенденций в области медицины и медицинского права при минимальных затратах Вашего времени.
* Доступно только специалистам здравоохранения.
другие статьи этой академии:
Многосуточное телемониторирование (МТМ) — оптимальный метод контроля при медикаментозном лечении аритмий
Время прочтения: 6 мин.
По показаниям в ходе МТМ пациентам выполнялись дополнительные обследования (ментальные, нагрузочные пробы), позволявшие оценить вклад психического и физического стресса в аритмогенез, а также участие вегетативной нервной системы (ВНС)
К полному тексту статьи >>Тревога и сердечно-сосудистые заболевания
Время прочтения: 9 мин.
Тревога и расстройства вегетативной регуляции являются верными спутниками практически любой соматической патологии. Наряду с этим, тревога является самостоятельным фактором развития и прогрессирования целого ряда заболеваний, в частности заболеваний сердечно-сосудистой систе...
К полному тексту статьи >>Практическая аритмология: от первичного приема до хирургического лечения. Диалоги в ординаторской
Время прочтения: 13 мин.
На сегодняшний день диагностика и лечение фибрилляции предсердий является крайне актуальной проблемой, требующей всестороннего, междисциплинарного подхода. Около 1 миллиона людей […]
К полному тексту статьи >>