Обоснование выбора антибиотика при инфекциях мочевыводящих путей с акцентом на экологическую безопасность антибактериальной терапии
С.В. Яковлев, М.П. Суворова
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Инфекции мочевыводящих путей (МВП) по частоте занимают второе место после острых респираторных инфекций, а среди них самыми частыми являются инфекции нижних отделов МВП – острый и рецидивирующий цистит. В этиологии острых респираторных инфекций преобладают вирусы, и в последние годы эксперты настоятельно не рекомендуют назначать антибиотики при нетяжелых инфекциях верхних дыхательных путей, в то же время инфекции нижних МВП являются преимущественно бактериальными и подразумевается обязательное назначение антибактериальной терапии. Таким образом, частота назначений антибиотиков в амбулаторной практике для лечения инфекций МВП не уступает, а может даже и превышает частоту назначения антибиотиков при респираторных инфекциях, по крайней мере у взрослых пациентов. Следовательно, правильное назначение антибиотиков при инфекциях МВП важно не только применительно к излечению конкретного пациента, но и в рамках всей медицины и общества с учетом современной стратегии сдерживания антибиотикорезистентности, что находит отражение в документах научных профессиональных обществ1,2, международных организаций3,4 и правительства РФ5.
Сложности правильного назначения антибиотиков при инфекциях нижних МВП объясняются тем, что такие пациенты приходят на прием не только к урологу, но также к врачу общей практики, терапевту, педиатру, гинекологу. Поэтому важна гармонизация практических рекомендаций по лечению цистита в разных медицинских дисциплинах. Кроме того, значительная часть женщин с симптомами острого цистита вообще не обращается к врачу и, приобретая антибиотик в аптеке, получает совет у работника первого стола. Нами проведено исследование (неопубликованные данные, в печати 2021 г.), что рекомендуют в Московских аптеках работники первого стола пациентам, описывающих симптомы острого цистита. Исследователи посетили 242 аптеки и в 80,2% случаев получили рекомендации приобрести антибиотик, причем только 68,4% предложенных антибиотиков были препаратами, рекомендуемыми для лечения острого цистита в Российских клинических рекомендациях6.
В последние годы были опубликованы клинические рекомендации по инфекциям МВП, как отечественные2,6, так и зарубежные7-9. Во всех рекомендациях разных стран эксперты пришли к консенсусу по выбору антибиотиков для лечения цистита:
- Антибиотики первой линии терапии: нитрофураны или фосфомицин трометамол;
- Антибиотики второй линии терапии: пероральные цефалоспорины III поколения или амоксициллин/клавуланат;
- Не рекомендуемые антибиотики: фторхинолоны, нефторированные фторхинолоны, ко-тримоксазол, незащищенные аминопенициллины.
Среди нитрофуранов в зарубежных рекомендациях приводится нитрофурантоин, в отечественных рекомендациях есть также фуразидин, который отсутствует в большинстве стран Европы и Америки. В свою очередь, в зарубежных рекомендациях упомянут в первой линии также пивмециллинам, который в нашей стране отсутствует.
Практически важно обсудить, какие учетные факторы принимают во внимание эксперты, рекомендуя или не рекомендуя антибиотик для лечения наиболее частой инфекции МВП – острого и рецидивирующего цистита. Цистит относится к не тяжелым инфекциям, поэтому врачи иногда позволяют себе небольшое творчество и вольно подходят к трактовке рекомендаций, в отличие от более тяжелых инфекций с серьезным прогнозом, например, пиелонефрита, сепсиса.
В отличие от пиелонефрита, который является тканевой инфекцией с частым развитием бактериемии, при цистите бактериальная инвазия захватывает в основном слизистую оболочку мочевого пузыря, поэтому создание высоких концентраций антибиотика в моче, а не в тканях является основным фармакологическим условием возможности применения препарата при этом заболевании. В результате те антибиотики, которые характеризуются преимущественно почечным путем выведения, отвечают этим условиям. Однако, в антимикробной терапии есть еще микроорганизм – возбудитель инфекции, поэтому для лечения цистита требуются антибиотики, которые проявляют высокую природную активность против наиболее актуальных возбудителей данной инфекции. Со временем микробы приобретают способность выживать в присутствии антибиотика, то есть формировать антибиотикорезистентность. Поэтому текущая ситуация с резистентностью основных возбудителей мочевых инфекциям является третьим учетным фактором, который надо принимать во внимание, рекомендуя антибиотик. И наконец, новая концепция рациональной антимикробной терапии подразумевает учитывать экологическую безопасность антибиотика, то есть его способность вызывать нарушение биоценоза на микро- и макроэкологическом уровне и вызывать селекцию антибиотикорезистентных бактерий. Эту новую концепцию следует учитывать при назначении антибиотиков, так как в глобальном аспекте нашей стратегической целью является сдерживание антибиотикорезистентности. Перечисленные факторы следует учитывать экспертам при создании рекомендаций по лечению инфекций МВП для врачей разных специальностей.
Учетные факторы выбора антибиотика при цистите
1. Фармакокинетика антибиотика – преимущественно почечная экскреция с созданием высоких концентраций активного антибиотика в моче
2. Антимикробная характеристика антибиотика:
• Природная активность против наиболее актуальных возбудителей;
• Уровень приобретенной устойчивости микробов к антибиотикам в конкретном регионе
3. Экологическая безопасность антибактериальной терапии:
• Воздействие на микробиоту ЖКТ и урогенитальных органов – т.н. «коллатеральный» или «параллельный» ущерб, существенно различающийся для разных антибиотиков;
• Селекция под действием антибиотика полирезистентных бактерий.
Фармакокинетика антибиотика
Для некоторых классов антибиотиков характерна исключительно почечная экскреция, препараты не подвергаются метаболизму в печени и выводятся почками в неизмененном виде, поэтому в моче достигаются очень высокие концентрации, превышающие минимально подавляющую концентрацию (МПК) основных патогенов в десятки, а то и сотни раз. К таким классам антибиотиков относятся аминогликозиды, гликопептилы и липопептиды, сульфаниламиды, триметоприм, нитрофураны и фосфомицины.
Наоборот, антибиотики макролиды, линкозамиды, оксазолидиноны, тетрациклины, характеризуются в основном печеночной элиминацией с желчью или путем метаболизма до неактивных соединений, поэтому достижение терапевтических концентраций этих антибиотиков в моче проблематично, и они, как правило, не рекомендуются для лечения инфекций МВП.
Для бета-лактамных антибиотиков и фторхинолонов характерны различия в фармакокинетике среди представителей этих классов. Среди бета-лактамов преимущественно почечной экскрецией обладают все пенициллины и карбапенемы, а также большинство цефалоспоринов, однако есть исключения. Печеночное выведение характерно для цефалоспорина III поколения цефоперазона, а среди пероральных цефалоспоринов – цефдиторена, который, в отличие от цефиксима и цефтибутена, не создает терапевтических концентраций в моче.
Среди фторхинолонов преимущественно почечная экскреция характерна для ципрофлоксацина, левофлоксацина, норфлоксацина, офлоксацина. Пефлоксацин и моксифлоксацин выводятся преимущественно печенью, поэтому не применяются для лечения инфекций МВП.
Из антифунгальных препаратов терапевтические концентрации в моче достижимы при назначении флуконазола, а другие азолы (вориконазол, кетоконазол) имеют внепочечный путь элиминации, так же, как и эхинокандины.
Антимикробная характеристика антибиотика
Природная активность против наиболее актуальных возбудителей
Под природной активностью антибиотика подразумевают его спектр антимикробного действия. Практически важно выделять не только сам факт активности против возбудителя («чувствительный», «умеренно чувствительный» и «резистентный»), но и его природную выраженность (или силу воздействия), которая оценивается по величине МПК и соотносится с достижимыми концентрациями в очаге инфекции. В зависимости от этого выделяют сильную, умеренную и слабую природную активность, причем в отношении микробов, которые лишены каких-либо генов устойчивости – так называемые «дикие штаммы».
Инфекции МВП является, как правило, моноинфекциями, то есть в качестве этиологического фактора выступает только один микроорганизм. По данным большинства проведенных эпидемиологических исследований ведущим возбудителем острого цистита является Escherichia coli. Доля E.coli в этиологии неосложненного цистита была очень высока (80-90%) в ранних исследованиях, проведенных до 2010 года10-12, в последующих исследованиях несколько снизилась13-14.
В многоцентровом международном исследовании ARESC13 изучена этиология острого несложненного цистита. E.coli занимала доминирующую позицию (72,6%), значительно меньшее значение имели Klebsiella pneumoniae (4,6%), Proteus mirabilis (2,4%), Staphylococcus saprophyticus (3,6%), другие Enterobacterales и Enterococcus spp. (11,1%), другие стафилококки и страптококки (5,8%). Хочется подчеркнуть, что существенное доминирование E.coli прослеживается в исследованиях, где изучали этиологию острого неосложненного цистита.
В проведенном 2017 г. в России большом многоцентровом исследовании с охватом практически всех регионов страны изучена этиологическая структура инфекций МВП у 84318 пациентов, от которых получено 41510 изолятов уропатогенов, причем эти пациенты были как с неосложненными, так и осложненными и рецидивирующими инфекциями15. Ведущим возбудителем также была кишечная палочка, но ее доля была ниже (49,1%), чем при неосложненных инфекциях. При осложненных и рецидивирующих инфекциях существенно выше роль K. pneumoniae (9,5%), Enterococcus faecalis (8,7%), Enterococcus spp. (6,9%), S.saprophyticus (6,1%); среди других возбудителей выявлены стрептококки группы В (4,6%), P.mirabilis (2,9%), S.aureus (1,2%).
Таким образом, следует учитывать определенные различия в этиологии острых и рецидивирующих инфекций МВП, неосложненных и осложненных:
Острый неосложненный цистит
- • Преимущественно E.coli
Осложненный или рецидивирующий цистит
- • E.coli + Klebsiella pneumoniae +/- Proteus mirabilis
- • Enterococcus faecalis +/- Staphylococcus saprophyticus
- • Грамположительные возбудители ≈ 20%
- • Enterococcus faecalis +/- Staphylococcus saprophyticus
Природная активность антибиотиков против наиболее актуальных возбудителей цистита приведена в таблице ниже:
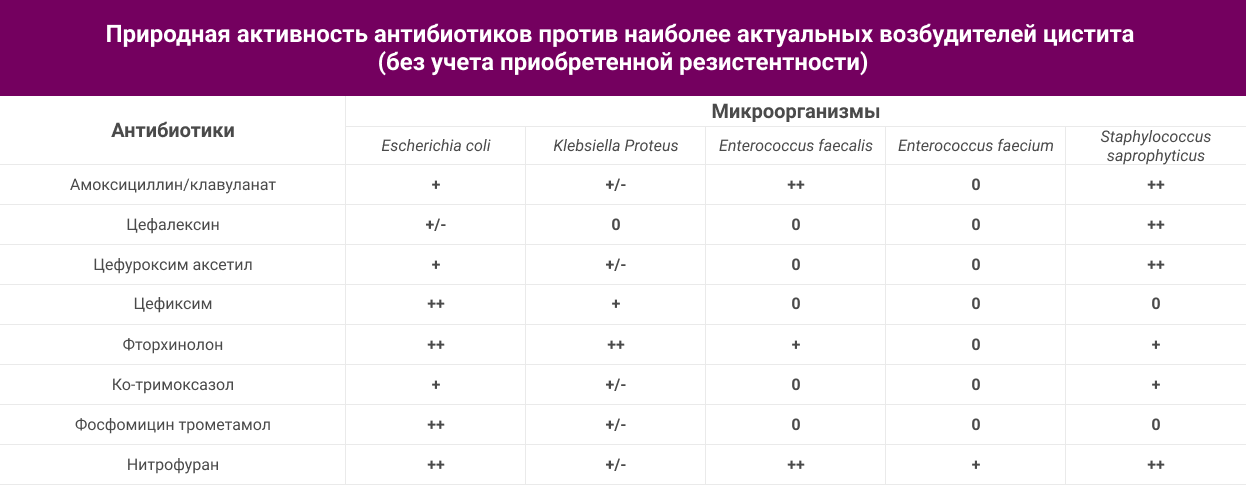
Обозначение природной активности:
++ сильная активность: антибиотик рекомендован в первой линии терапии;
+ умеренная активность: антибиотик может применяться во второй линии терапии;
+/- слабая активность: антибиотик может назначаться только при отсутствии другой альтернативы лечения;
0 – отсутствие активности.
В отношении основного возбудителя цистита кишечной палочки все приведенные антибиотики обладают природной активностью, однако сила воздействия разная: наиболее высокая природная активность имеется у цефалоспоринов III поколения, фторхинолонов, нитрофуранов и фосфомицина трометамола. Несколько ниже природная активность у амоксициллина/клавуланат и цефалоспорина II поколения цефуроксима; у цефалоспоринов I поколения, в частности, цефалексина активность против E.coli крайне слабая, что нужно учитывать, так как в некоторых зарубежных рекомендациях данных антибиотик позиционируется для профилактики7,8. В отношении других грамотрицательных патогенов высокой активностью обладают только фторхинолоны, активность других антибиотиков ниже и существенно варьирует.
В отношении E.faecalis реальной активностью обладают только нитрофураны и аминопенициллины, частично – фторхинолоны (левофлоксацин > ципрофлоксацин); другие антибиотики лишены природной антиэнтерококковой активности. Неоднозначный вопрос по антиэнтерококковой активности фосфомицина трометамола. В инструкции по медицинскому применению фосфомицина трометамола сказано о наличии такой активности, в наиболее известном справочнике The Sanford Guide16 приводятся данные о слабой и вариабельной активности, не позволяющей рекомендовать антибиотик в монотерапии.
По данным базы данных Европейской организации EUCAST (European Committee on Antimicrobial Susceptibility Testing), регламентирующие правила который рекомендованы для применения в лабораториях РФ, фосфомицин не обладает реальной активностью против энтерококков17. На рисунке 1 приведены распределения МПК нитрофурантоина и фосфомицина для «диких» штаммов E.faecalis и S.saprophyticus, выделенных во всех странах Европы и лишенных каких-либо механизмов устойчивости. Вертикальная линия обозначена нами для разделения чувствительной популяции (слева от линии) от устойчивой (справа) в соответствии с пограничными критериями: для нитрофурантоина – 64 мг/л, для фосфомицина – 8 мг/л. Видно, что если значения МПК нитрофурантоина практически всех штаммов E.faecalis находится в диапазоне чувствительности, то для фосфомицина все значения МПК выше 8 мг/л, то есть находятся в диапазоне устойчивости. Сходное заключение можно сделать при анализе распределения МПК для S.saprophyticus, то есть реальная антистафилококковая активность у фосфомицина трометамола отсутствует.
В отношении E.faecium нитрофурантоин является единственным антибиотиком из перечисленных, обладающим природной активностью, в отношении стафилококков, наряду с нитрофурантоином, также высоко активны амоксициллин/клавуланат и цефалоспорины I-II поколения, ниже активность у фторхинолонов и ко-тримоксазола.
Уровень приобретенной устойчивости микробов к антибиотикам в конкретном регионе
Текущую ситуацию с региональной антибиотикорезистентность уропатогенов следует учитывать при разработке рекомендаций по лечению. В таблице 2 приведены данные о резистентности грамотрицательных возбудителей инфекций МВП (неосложненные + осложненные, острые + рецидивирующие), полученные в самом крупном эпидемиологическом исследовании RESOURCE, недавно проведенном в России (84318 анализов мочи, 41510 штаммов уропатогенов)15.
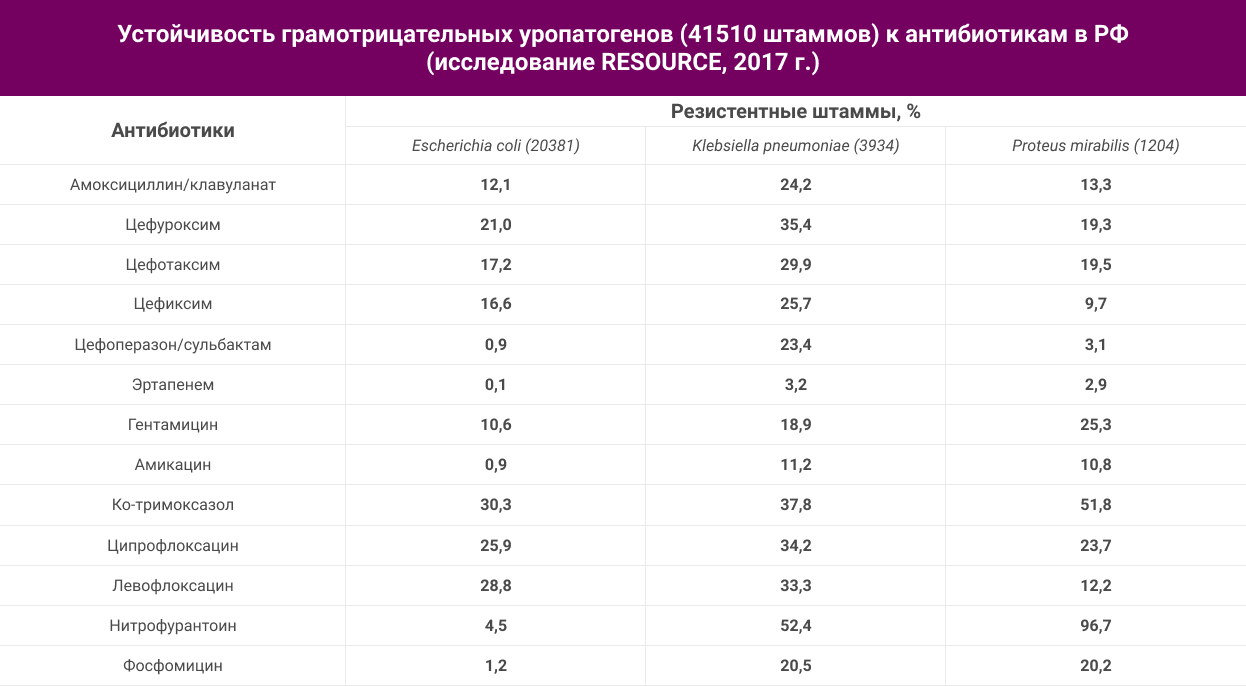
Для обсуждения этих результатов необходимо ввести понятие «Эпидемиологического порога отсечения» или «Epidemiological breakpoint», который используется для разграничения допустимого и высокого уровня устойчивости уропатогенов в популяции. В зарубежных и Российских клинических рекомендациях приводится порог отсечения 20% для внебольничных уропатогенов2,7,9, подразумевая, что антибиотик может быть рекомендован при устойчивости ниже 20% и ограничен для использования при резистентности свыше порога отсечения.
В отношении самого частого возбудителя цистита E.coli устойчивость ниже порога отсечения наблюдается для нескольких пероральных антибиотиков – фосфомицин трометамол, нитрофурантоин, амоксициллин/клавуланат и цефиксим, а также парентеральных антибиотиков – амикацин, гентамицин, цефотаксим, цефоперазон/сульбактам. Последний антибиотик не применяется для лечения инфекций МВП из-за особенностей его фармакокинетики, но служит микробиологическим маркером чувствительности к другим ингибиторозащищенным цефалоспоринам (цефепим/сульбактам, цефотаксим/сульбактам), которые могут назначаться в стационаре для лечения госпиталированных пациентов.
Если в отношении E.coli есть несколько возможностей терапии, то против других грамотрицательных уропатогенов опции пероральной терапии в амбулаторной практике крайне лимитированы: в случае K.pneumoniae есть возможность применения фосфомицина трометамола (устойчивость 20,5%), а при P.mirabilis – цефиксима и фосфомицина трометамола. Таким образом, в случае осложненных и рецидивирующих инфекций МВП, вызванных K.pneumoniae, надежные опции пероральной терапии отсутствуют, а такой пациент вероятно должен быть госпитализирован для проведения парентеральной антибактериальной терапии карбапенемом или амикацином. Следует также отметить, что новые фторхинолоны (левофлоксацин) не имеют преимущества в отношении грамотрицательных уропатогенов по сравнении с ципрофлоксацином, а цефалоспорин II поколения цефуроксим уступает цефалоспоринам III поколения.
В исследовании RESOURCE15 приведена динамика формирования устойчивости уропатогенной E.coli к антибиотикам в РФ (рисунок 2). Следует обратить внимание на быстрое формирование устойчивости к фторхинолонам (за 20 лет увеличение с 2 до 26%), и, к сожалению, такая же тенденция прослеживается для амоксициллина/клавуланата и цефалоспорином III поколения, что объясняет перевод этих антибиотиков в средства второй линии терапии. Минимальная устойчивость сохраняется только к нитрофуранам и фосфомицину трометамолу, хотя в отношении последнего есть определенная озабоченность в прогнозировании роста устойчивости, так как парентеральный фосфомицин в последние 5-7 лет стал широкого применяться в медицине для лечения инфекций, вызванных карбапенем-резистентной K.pneumoniae.
Экологическая безопасность антибактериальной терапии
Важное значение экологической безопасности применения антибиотиков впервые приводится в отечественных документах – Резолюции экспертного совета 2014 г.1 и Евразийских рекомендациях по рациональному применению антибиотиков в амбулаторной практике 2016 года2. В этих документах указано на возможные экологически неблагоприятные последствия антибиотикотерапии, которые надо учитывать при создании рекомендаций по выбору антибиотиков для лечения различных инфекций, наряду с природной антимикробной активностью и состояние антибиотикорезистентности.
Возможные экологически неблагоприятные последствия антибактериальной терапии приведены ниже. Безопасность антибиотиков включает фармакологическую и экологическую безопасность. Как и все лекарственные препараты, антибиотики могут приводить к развитию нежелательных лекарственных реакций, которые включают аллергические реакции, идиосинкразию и органотоксичность. Аллергические реакции наиболее характерны для бета-лактамным антибиотикам, среди них чаще развивается на природные и полусинтетические пенициллины. Риск перекрестной аллергии между пенициллинами и цефалоспоринами невысокий и для препаратов III поколения не превышает 1%. Органотоксичность – более актуальная НЛР, риск ее возникновения надо особенно учитывать в амбулаторной практике из-за сложности лабораторного контроля функции органов. Так, особую тревогу в последние годы вызывает органотоксичность фторхинолонов (нейротоксичность, кардиотоксичность, гепатотоксичность, артро- и хондротоксичность), что объясняет рекомендации регуляторных органов по ограничению назначений этих антибиотиков в амбулаторной практике при нетяжелых инфекциях, в частности для лечения цистита18-19.
Экологически неблагоприятные последствия применения антибиотиков включают:
- • Изменение микробиоты желудочно-кишечного тракта, нижних МВП, влагалища, кожи;
- • Мутации микроорганизмов с формированием устойчивости к антибиотикам, селекция антибиотикорезистентных штаммов бактерий;
- • Развитие суперинфекции, вызванной Clostridium difficile (антибиотикоассоциированная диарея и псевдомембранозный колит);
- • Развитие суперинфекции МВП, вызванной полирезистентными микроорганизмами.
Важным неблагоприятным экологическим последствием является изменение микробиома человека, прежде всего, сбалансированной микробиоты кишечника, которое может сопровождаться не только формированием резистентности, но и существенными нарушениями обмена веществ в организме человека20-21. Некоторые антибиотики в большей степени приводят к нарушению баланса кишечной микрофлоры и рискам формирования резистентных штаммов, другие обладают минимальным подобным эффектом. К наиболее существенным и долго сохраняющимся изменениям микробиоты кишечника приводит применение фторхинолонов, клиндамицина и кларитромицина в сочетании с метронидазолом22. В то же время нитрофураны не приводят к выраженным изменениям микробиоты кишечника по сравнению с фторхинолонами23-24.
Влияние антибиотиков на кишечную микрофлору также связано с биодоступностью, то есть степень всасывания в кишечнике. Чем более полно всасывается антибиотик, тем меньшее его количество остается в кишечнике и тем меньшее будет повреждающие действие на микробиоту кишечника. Поэтому оптимизированные лекарственные формы антибиотика с более высокой биодоступностью в экологическом плане более безопасны. В частности, биодоступность растворимой калиевой соли фуразидина в комплексе с гидрокарбонатом магния (препарат фурамаг) имеет биодоступность, более чем в два раза превышающую таковую при применении обычных таблеток фуразидина.
Повреждающее действие антибиотика на кишечную микрофлору и связанное с этим формирование и селекция антибиотикорезистентных штаммов, принято обозначать коллатеральным повреждением (Collateral damage) или сопутствующим (параллельным) ущербом антибиотикотерапии. Антибиотики – таргентные препараты, способные распознавать свою уникальную мишень в прокариотической клетке. Любой антибиотик обладает определенным спектром антимикробной активности, то есть имеет сродство со своей мишенью, расположенной в разных микроорганизмах. При неосложненных инфекциях МВП основным целевым микробом является E.coli, в которой имеется мишень для многих антибиотиков. В результате подавление антибиотиком кишечной палочки при инфекции МВП является его терапевтическим действием, а подавление жизнедеятельности других микробов – нормальной микрофлоры кишечника, урогенитального тракта, кожи – рикошетом или сопутствующим ущербом. Для некоторых антибиотиков сопутствующий ущерб при его применении может превышать терапевтический, что приводит к серьезным нарушениям микробиоценоза, то есть экологическим повреждениям. В идеале антибиотик должен иметь спектр действия не широкий, а достаточный для киллинга наиболее актуальных возбудителей инфекции. То есть при выборе антибиотика в амбулаторной практике для лечения нетяжелых инфекций должен доминировать принцип «минимальной достаточности» спектра антимикробной активности, то есть при прочих равных условиях надо отдавать предпочтение антибиотику с более узким спектром, что впервые обосновано в клинических рекомендациях по правилам применения антимикробынх препаратов2.
В таблице 3 приведен природный спектр антибиотиков для лечения инфекций МВП, где наглядно видно, что нитрофураны характеризуются минимальным сопутствующим ущербом при лечении цистита, а значит должны быть предпочтительными антибиотиками в этой ситуации. В клинических рекомендациях IDSA и ESCMID обосновывается применение нитрофуранов и фосфомицина в первой линии терапии цистита именно благодаря их минимальному сопутствующему ущербу7.
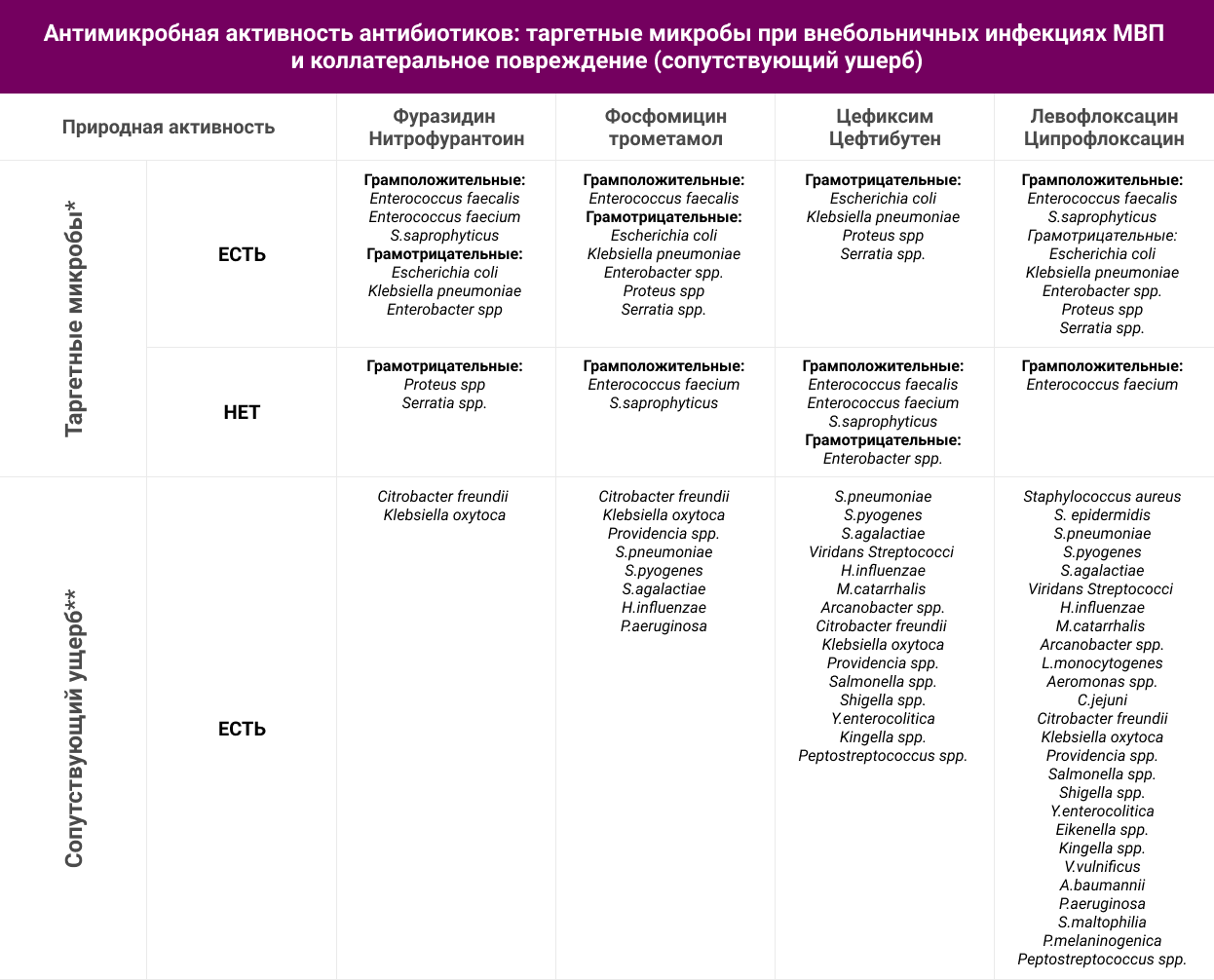
* Микроорганизмы, имеющие значение в этиологии внебольничных инфекций МВП;
** Микроорганизмы, не рассматриваемые в качестве этиологических агентов внебольничных инфекций МВП.
Некоторые антибиотики в большей степени, чем другие способны провоцировать формирование устойчивости микроорганизмов и вызывать селекцию резистентных штаммов. Так, в работе M. Gobernado с соавт.25 показана прямая корреляционная зависимость между объемом потребления фторхинолонов в 20 больницах Испании и уровнем резистентности E.coli к фторхинолонам с коэффициентом корреляции 0,5 (Р=0,025). Наибольший коллатеральный ущерб в амбулаторной практике наблюдается при применении цефалоспоринов III поколения, вызывающих селекцию бета-лактамаз расширенного спектра и устойчивость к цефалоспоринам26-29, фторхинолонов (селекция устойчивых стафилококков, синегнойной палочки, риск суперинфекции, вызванной C.difficile)26-27, азитромицина (рост устойчивости пневмококков и стрептококков к макролидам и бета-лактамам)30-32.
Классическим примером возникновения и селекции устойчивых микробов является широкое и необоснованное назначение ванкомицина внутрь для профилактики клостридиальной диареи в ОРИТ США в 1980-х годах и быстрое распространение в этих отделениях ванкомицин-резистентных энтерококков33.
В качестве разумных мер достижения экологической безопасности антимикробной терапии и минимизации риска сопутствующего (параллельного) ущерба в урологии могут быть обоснованы следующие мероприятия:
1. Ограничение необоснованного и пролонгированного применения антибиотиков для лечения и профилактики инфекций:
- a. Не лечить бессимптомную бактериурию, за исключением беременных женщин;
- b. Не лечить катетер-ассоциированную бактериурию и лейкоцитурию при отсутствии симптомов инфекции МВП;
- c. Короткие курсы периоперационной антибиотикопрофилактики – в идеале одна предоперационная доза, при высоком риске осложнений продление профилактики максимум на 24 часа;
- d. Исключить профилактические курсы антибиотиков при хронических и рецидивирующих инфекциях МВП. При необходимости профилактики использовать неантибактериальные средства (лиофилизированный лизат штаммов кишечной палочки, D-манноза, клюква, фитопрепараты, вагинальная эстрогенозаместительная терапия в постменопаузе);
- e. Продленные курсы антибиотиков при цистите – нитрофураны, бета-лактамы > 7 дней.
2. При выборе антибиотика отдавать предпочтение препаратам с низким потенциалом селекции устойчивых микроорганизмов и минимальным риском развития сопутствующего ущерба. В качестве средств первой линии терапии при неосложненном цистите обосновано рекомендованы нитрофураны (фуразидин, нитрофурантоин) и фосфомицин трометамол не только из-за низкого уровня к ним резистентности, но и минимального риска возникновения сопутствующего ущерба. При осложненном и рецидивирующем цистите более предпочтительными антибиотиками являются нитрофураны, так как, в отличие от фосфомицина, проявляют активность против энтерококков и обладают более высоким эрадикационным потенциалом, что документировано в клинических исследованиях34-35.
Эксперты ВОЗ также обращают внимание врачей на принцип «минимальной достаточности» при назначении антибиотика для снижения риска сопутствующего ущерба. В последнем документе ВОЗ приводятся три группы антибиотиков по приоритету выбора: ACCESS (приоритетный выбор – минимальный сопутствующий ущерб), WATCH (вторая линия, возможен сопутствующий ущерб), RESERVE (резерв – при отсутствии другой альтернативы лечения)36-37. Из антибиотиков для лечения инфекций МВП в группу приоритетного выбора ACCESS эксперты включили только нитрофурантоин, а фосфомицин трометамол, цефалоспорины III поколения и фторхинолоны приводятся в группе WATCH.
В заключение следует подчеркнуть, что экологическую безопасность антимикробной терапии является важным компонентом сдерживания антибиотикорезистентности на глобальном и локальном уровнях.
Литература
1. Яковлев С.В., Сидоренко С.В., Рафальский В.В. Антибиотикорезистентность как угроза национальной безопасности: фокус на мероприятия в амбулаторно-поликлиническом звене здравоохранения. Резолюция. Вестник практического врача 2014; №3: 8-13.
2. Стратегия и тактика рационального применения антимикробных средств в амбулаторной практике: Евразийские клинические рекомендации / под ред. С. В. Яковлева, С. В. Сидоренко, В. В. Рафальского, Т. В. Спичак. М..: Издательство «Пре100 Принт», 2016 – 121 с.
3. WHO Global Strategy for Containment of Antimicrobial Resistance. World Health Organization, 2001. (Assessed at http://www.who.int/drugresistance/WHO_Global_Strategy_English.pdf?ua=1).
4. ECDC/EMEA Joint Technical Report: The bacterial challenge: time to react, September 2009 (доступно по ссылке: http://ecdc.europa.eu/en/publications/Publications/0909_TER_The_Bacterial_Challenge_Time_to_React.pdf).
5. Стратегия предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года. Распоряжение Правительства Российской Федерации от 25 сентября 2017 года, № 2045-р.
6. Цистит бактериальный у взрослых. Клинические рекомендации. Министерство здравоохранения РФ. https://cr.minzdrav.gov.ru/
7. Gupta K, Hooton TM, Naber KG, Wullt B, Colgan R, Miller LG, Moran GJ, Nicolle LE, Raz R, Schaeffer AJ, Soper DE; Infectious Diseases Society of America; European Society for Microbiology and Infectious Diseases. International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: A 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases. Clin Infect Dis. 2011 Mar 1;52(5):e103-20. doi: 10.1093/cid/ciq257.
8. Kranz J, Schmidt S, Lebert C, Schneidewind L, Vahlensieck W, Sester U, Fünfstück R, Helbig S, Hofmann W, Hummers E, Kunze M, Kniehl E, Naber K, Mandraka F, Mündner-Hensen B, Schmiemann G, Wagenlehner FME. Epidemiologie, Diagnostik, Therapie, Prävention und Management unkomplizierter, bakterieller, ambulant erworbener Harnwegsinfektionen bei erwachsenen Patienten : Aktualisierung 2017 der interdisziplinären AWMF S3 Leitlinie. Urologe A. 2017 Jun;56(6):746-758. German. doi: 10.1007/s00120-017-0389-1.
9. G. Bonkat, R. Bartoletti, F. Bruyère, T. Cai, S.E. Geerlings, B. Köves, S. Schubert, F. Wagenlehner. EAU Guidelines on Urological infections 2021. European Association of Urology. ISBN 978-94-92671-13-4. https://uroweb.org/guideline/urological-infections/.
10. L.S. Stratchounski, V.V. Rafalski. Antimicrobial susceptibility of pathogens isolated from adult patients with uncomplicated community-acquired urinary tract infections in the Russian Federation: two multicentre studies, UTIAP-1 and UTIAP-2. Int J Antimicrob Agents, 28 Suppl 1 (2006), pp. S4-9.
11. V.V. Rafal’skii, L.S. Strachunskii, O.I. Krechikova, I.A. Eĭdel’shteĭn, L.I. Akhmetova, P.A. Babkin, et al. Resistance of ambulatory urinary infection pathogens according to the data of multicenter microbiological studies UTIAP-I and UTIAP-II. Urologiia (2) (2004), pp. 13-17 [Article in Russian].
12. V.V. Rafal’skii, L.S. Strachunskii, P.A. Babkin, V.S. Valenskaia, L.A. Gabbasova, O.B. Dmitrieva, et al. Resistance of causative agents of uncomplicated urinary tract infections in Russi. Urologiia (5) (2006), pp. 34-37 [Article in Russian].
13. Schito GC, Naber KG, Botto H, Palou J, Mazzei T, Gualco L, Marchese A. The ARESC study: an international survey on the antimicrobial resistance of pathogens involved in uncomplicated urinary tract infections. Int J Antimicrob Agents. 2009 Nov;34(5):407-13. doi: 10.1016/j.ijantimicag.2009.04.012.
14. I.S. Palagin, M.V. Sukhorukova, A.V. Dekhnich, M.V. Edelstein, T.S. Perepanova, R.S. Kozlov, et al. Current state of antibiotic resistance of pathogens causing community-acquired urinary tract infections in Russia: «DARMIS» Study (2010–2011). Clin Microbiol Antimicrob Chemother, 14 (4) (2012), pp. 280-303.
15. Rafalskiy V, Pushkar D, Yakovlev S, Epstein O, Putilovskiy M, Tarasov S, Glazunov A, Korenev S, Moiseeva E, Gorelysheva N. Distribution and antibiotic resistance profile of key Gram-negative bacteria that cause community-onset urinary tract infections in the Russian Federation: RESOURCE multicentre surveillance 2017 study. J Glob Antimicrob Resist. 2020 Jun;21:188-194. doi: 10.1016/j.jgar.2019.09.008.
16. The Sanford Guide to Antimicrobial Therapy 2021. Ed. By DN Gilbert, HF Chambers, MS Saag, AT Pavia, HW Boucher. 51st Edition. Antimicrobial Therapy, Inc., USA, 2021.
17. База данных EUCAST. https://mic.eucast.org/
18. FDA updates warnings for fluoroquinolone antibiotics. http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm513183.htm
19. European Medicines Agency. Fluoroquinolone and quinolone antibiotics: PRAC recommends restrictions on use. 5 October 2018. EMA/668915/2018.
20. Ursell LK, Haiser HJ, Van Treuren W, Garg N, Reddivari L, Vanamala J, Dorrestein PC, Turnbaugh PJ, Knight R. The intestinal metabolome: an intersection between microbiota and host. Gastroenterology. 2014 May;146(6):1470-6. doi: 10.1053/j.gastro.2014.03.001.
21. Fujimura KE, Slusher NA, Cabana MD, Lynch SV. Role of the gut microbiota in defining human health. Expert Rev Anti Infect Ther. 2010 Apr;8(4):435-54. doi: 10.1586/eri.10.14.
22. Zimmermann P, Curtis N. The effect of antibiotics on the composition of the intestinal microbiota – a systematic review. J Infect. 2019 Dec;79(6):471-489. doi: 10.1016/j.jinf.2019.10.008.
23. Vervoort J, Xavier BB, Stewardson A, Coenen S, Godycki-Cwirko M, Adriaenssens N, Kowalczyk A, Lammens C, Harbarth S, Goossens H, Malhotra-Kumar S. Metagenomic analysis of the impact of nitrofurantoin treatment on the human faecal microbiota. J Antimicrob Chemother. 2015 Jul;70(7):1989-92. doi: 10.1093/jac/dkv062.
24. Stewardson AJ, Gaïa N, François P, Malhotra-Kumar S, Delémont C, Martinez de Tejada B, Schrenzel J, Harbarth S, Lazarevic V; SATURN WP1 and WP3 Study Groups. Collateral damage from oral ciprofloxacin versus nitrofurantoin in outpatients with urinary tract infections: a culture-free analysis of gut microbiota. Clin Microbiol Infect. 2015 Apr;21(4):344.e1-11. doi: 10.1016/j.cmi.2014.11.016.
25. Gobernado M, Valdés L, Alós JI, García-Rey C, Dal-Ré R, García-de-Lomas J; Spanish Surveillance Group for Urinary Pathogens. Antimicrobial susceptibility of clinical Escherichia coli isolates from uncomplicated cystitis in women over a 1-year period in Spain. Rev Esp Quimioter. 2007 Mar;20(1):68-76.
26. Saner FH, Canbay A, Gerken G, Broelsch CE. Kollateralschaden der Cephalosporine und Chinolone und Wege zu ihrer Reduktion [Collateral damage of cephalosporins and quinolones and possibilities for control]. Med Klin (Munich). 2009 Feb 15;104(2):114-8. German. doi: 10.1007/s00063-009-1022-x.
27. Paterson DL. “Collateral damage” from cephalosporin or quinolone antibiotic therapy. Clin Infect Dis. 2004 May 15;38 Suppl 4:S341-5. doi: 10.1086/382690.
28. Kim JY, Sohn JW, Park DW, Yoon YK, Kim YM, Kim MJ. Control of extended-spectrum {beta}-lactamase-producing Klebsiella pneumoniae using a computer-assisted management program to restrict third-generation cephalosporin use. J Antimicrob Chemother. 2008 Aug;62(2):416-21. doi: 10.1093/jac/dkn164.
29. Lee J, Pai H, Kim YK, Kim NH, Eun BW, Kang HJ, Park KH, Choi EH, Shin HY, Kim EC, Lee HJ, Ahn HS. Control of extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae in a children’s hospital by changing antimicrobial agent usage policy. J Antimicrob Chemother. 2007 Sep;60(3):629-37. doi: 10.1093/jac/dkm225.
30. Golikova M, Strukova E, Alieva K, Portnoy Y, Dovzhenko S, Kobrin M, Zinner S, Firsov A. Comparatine resistance studies using in vitro dynamic models: amoxicillin versus azithromycin against Streptococcus pneumoniae. ECCMID 2017, Poster P0251 (www.eccmid.org).
31. Baquero F. Evolving resistance patterns of Streptococcus pneumoniae: a link with long-acting macrolide consumption? J Chemother. 1999 Feb;11 Suppl 1:35-43.
32. Vanderkooi OG, Low DE, Green K, Powis JE, McGeer A. Predicting antimicrobial resistance in invasive pneumococcal infections. Clin Infect Dis. 2005 May 1;40(9):1288-97.
33. Bonten MJ, Willems R, Weinstein RA. Vancomycin-resistant enterococci: why are they here, and where do they come from? Lancet Infect Dis. 2001 Dec;1(5):314-25. doi: 10.1016/S1473-3099(01)00145-1.
34. Stein GE. Comparison of single-dose fosfomycin and a 7-day course of nitrofurantoin in female patients with uncomplicated urinary tract infection. Clin Ther. 1999 Nov;21(11):1864-72. doi: 10.1016/S0149-2918(00)86734-X.
35. Huttner A, Kowalczyk A, Turjeman A, Babich T, Brossier C, Eliakim-Raz N, Kosiek K, Martinez de Tejada B, Roux X, Shiber S, Theuretzbacher U, von Dach E, Yahav D, Leibovici L, Godycki-Cwirko M, Mouton JW, Harbarth S. Effect of 5-Day Nitrofurantoin vs Single-Dose Fosfomycin on Clinical Resolution of Uncomplicated Lower Urinary Tract Infection in Women: A Randomized Clinical Trial. JAMA. 2018 May 1;319(17):1781-1789. doi: 10.1001/jama.2018.3627.
36. The selection and use of essential medicines. Report of the WHO Expert Committee on Selection and Use of Essential Medicines, 2017 (including the 20th WHO Model List of Essential Medicines and the 6th WHO Model List of Essential Medicines for Children). Доступно на сайте ВОЗ: (http://apps.who.int/iris/bitstream/handle/10665/259481/9789241210157-eng.pdf;jsessionid=B30EB53483079A0031CFAC1708FE542E?sequence=1).
37. WHO/MVP/EMP/IAU/2019.10; The 2019 WHO AWaRe classification of antibiotics for evaluation and monitoring of use.
Инфекции мочевыводящих путей – одна из наиболее частых причин назначения антибактериальных средств.
Однако не стоит забывать, что широкое распространение антибиотиков ведёт к стремительному формированию антибиотикорезистентных штаммов. Поэтому, оценивая масштаб угрозы здоровью нашего населения, перед врачом стоит непростая задача: каждый раз при выборе терапии придерживаться стратегии предупреждения антибиотикорезистентности и назначать антибактериальный препарат в соответствии с его фармакокинетикой, антимикробной характеристикой и уровнем устойчивости микробов в конкретном регионе.
Подробнее о принципах экологической безопасности и рациональной антибиотикотерапии читайте в следующей статье.

Зарегистрируйтесь, чтобы получить полный доступ к материалам
Зарегистрируйтесь на портале и получайте доступ к закрытому уникальному контенту*. Вы будете в курсе последних тенденций в области медицины и медицинского права при минимальных затратах Вашего времени.
* Доступно только специалистам здравоохранения.
другие статьи этой академии:
Эффективность компрессионной терапии в профилактике венозных тромбоэмболических осложнений у пациентов с COVID-19
Время прочтения: 16 мин.
Основным методом профилактики ВТЭО является антикоагулянтная терапия. Однако ее применение не всегда возможно. Например, у пациентов с большими и значимыми кровотечениями. Единственным способом профилактики в данном случае является эластическая компрессия. Данный метод недоо...
К полному тексту статьи >>XXII Конгресс Российского общества урологов
Время прочтения: 11 мин.
15-17 сентября 2022 года прошел долгожданный XXII Конгресс Российского общества урологов, который объединил 1000 специалистов из России и зарубежных стран. В течение четырех дней были представлены последние достижения науки и инновационные подходы к лечению пациентов....
К полному тексту статьи >>Устойчивость планктонной и биопленочной форм кишечной палочки E. coli к растворимым нитрофуранам
Время прочтения: 5 мин.
Проблема антибиотикорезистентности на данный момент остается одной из наиболее актуальных и глобальных для всего медицинского сообщества. Образование биопленок – это один из механизмов формирования устойчивости бактериальных клеток. Нитрофураны являются препаратами первой ли...
К полному тексту статьи >>